La cirugía toracoscópica o torácica videoasistida (VATS) de la región torácica y lumbar ha evolucionado desde su aparición hace menos de 20años y hoy en día puede estar indicada su utilización en una gran cantidad de procesos y lesiones. El objetivo del siguiente trabajo (en sus 2 partes) es hacer una revisión de la situación actual de la VATS de la región torácica y lumbar en todo su espectro.
DesarrolloSe realiza una revisión de la literatura desarrollándose uno por uno los grandes grupos de indicaciones donde la VATS tiene lugar. En esta segunda parte se realiza la revisión y discusión en el manejo, el tratamiento y la técnica específica mediante toracoscopia de la hernia de disco torácica, de las deformidades raquídeas, de la patología tumoral, de los procesos infecciosos de la columna y del resto de indicaciones posibles para la VATS.
ConclusionesLa cirugía toracoscópica es en muchos casos una alternativa a la cirugía abierta convencional. El uso del abordaje transdiafragmático ha hecho posible el tratamiento toracoscópico de gran cantidad de procesos de la unión toracolumbar. Se ha ampliado el abanico de indicación terapéutica, que incluye el tratamiento de deformidades, tumores, infecciones y otros procesos patológicos, así como la reconstrucción de los segmentos raquídeos lesionados y la descompresión del canal raquídeo si la disposición de la lesión es favorable al abordaje anterolateral. Los buenos resultados clínicos de la VATS están avalados por una creciente experiencia plasmada en un elevado número de trabajos. El grado de complicaciones de la cirugía toracoscópica es comparable al de la cirugía abierta, con ventajas respecto a la morbilidad del abordaje y a la recuperación posterior de los pacientes.
Thoracoscopic surgery or video-assisted thoracic surgery (VATS) of the thoracic and lumbar spine has evolved greatly since it appeared less than 20years ago. It is currently used in a large number of processes and injuries. The aim of this article, in its two parts, is to review the current status of VATS of the thoracic and lumbar spine in its entire spectrum.
DevelopmentAfter reviewing the current literature, we developed each of the large groups of indications where VATS takes place, one by one. This second part reviews and discusses the management, treatment and specific thoracoscopic technique in thoracic disc herniation, spinal deformities, tumour pathology, infections of the spine and other possible indications for VATS.
ConclusionsThoracoscopic surgery is in many cases an alternative to conventional open surgery. The transdiaphragmatic approach has made endoscopic treatment of many thoracolumbar junction processes possible, thus widening the spectrum of therapeutic indications. These include the treatment of spinal deformities, spinal tumours, infections and other pathological processes, as well as the reconstruction of injured spinal segments and decompression of the spinal canal if lesion placement is favourable to antero-lateral approach. Good clinical results of thoracoscopic surgery are supported by growing experience reflected in a large number of articles. The degree of complications in thoracoscopic surgery is comparable to open surgery, with benefits in regard to morbidity of the approach and subsequent patient recovery.
Tras describir y exponer en la primera parte del trabajo los requerimientos necesarios para la cirugía toracoscópica, seguida de la descripción de la técnica quirúrgica básica y del abordaje transdiafragmático junto con el manejo y tratamiento de las fracturas raquídeas, en esta segunda parte continuaremos con el resto de grupos de indicaciones que incluyen la hernia de disco torácica, las deformidades, la patología tumoral e infecciosa, la simpatectomía y un grupo de miscelánea.
Tratamiento toracoscópico de la hernia de disco torácicaSolo del 0,15 al 1%, o incluso menos, de las intervenciones realizadas por enfermedad degenerativa discal son para tratar una hernia de disco torácica1. Especialmente en la región torácica, las hernias pueden estar calcificadas o incluso ser intradurales, y los procedimientos quirúrgicos para el tratamiento de esta patología son técnicamente difíciles, ya que el canal raquídeo es estrecho en proporción al tamaño de la médula espinal. Así, hernias o protrusiones no excesivamente grandes pueden producir clínica que variará según la expansión y la localización de la hernia, que puede ser central, centrolateral, intraforaminal o extraforaminal. Existen diversos procedimientos para el tratamiento de la patología discal torácica, entre los que destacan:
- -
Abordaje transtorácico, abierto o por cirugía toracoscópica o torácica videoasistida (video-assisted thoracic surgery [VATS]), principalmente para hernias localizadas entre T4 y T11, de localización central con o sin calcificación.
- -
Abordaje lateral extracavitario para hernias comprendidas entre T6 y T12 de localización centrolateral.
- -
Abordaje transfacetario combinado o no con una resección parcial o total del pedículo (abordaje transpedicular), para todos los niveles y hernias de localización más lateral.
Debido a la alta morbilidad del abordaje transtorácico abierto, las indicaciones para esta patología en el pasado fueron pocas. Con la aparición del abordaje toracoscópico y de la mini-toracotomía2 el número de indicaciones de este tipo se ha incrementado, siendo las hernias de localización más lateral tratadas mediante abordajes posterolaterales. Es posible incluso tratar osificaciones del ligamento común posterior mediante VATS3.
Wait et al.4 han publicado recientemente los resultados de una serie de 121pacientes con 125procedimientos toracoscópicos para tratar 139hernias torácicas. Indicaciones para la cirugía fueron la existencia de pequeñas hernias sintomáticas de localización anterior, entre los niveles T4-T11, en pacientes sin obesidad mórbida y con una anatomía torácica favorable. La radiculopatía fue la presentación más frecuente, seguida de la mielopatía y del dolor (radiculopático o de espalda). La estancia media en el hospital fue de 4,8días, con un seguimiento medio de 2,4años. La mielopatía, la radiculopatía y el dolor de espalda se resolvieron o mejoraron en el 91,1, el 97,6 y el 86,5%, respectivamente, con un empeoramiento en el 0, el 1,2 y el 0%. El 97,4% de los pacientes refirieron que volverían a operarse por el mismo procedimiento. Se eligió una toracotomía en los casos de hernias gigantes, calcificadas y con probable afectación transdural, y se realizó un abordaje posterolateral en los casos donde las hernias no tenían una amplia base pero sí un componente más lateral. También se realizó un abordaje abierto en casos donde se requería operar 3 o más hernias y cuando la disposición de los grandes vasos desaconsejaba el abordaje por VATS. El número de complicaciones disminuyó a lo largo del tiempo, con el 28,3% en 46casos en los primeros 6años hasta el 5,3% en 75casos en los siguientes 9años; las complicaciones más frecuentes fueron el derrame pleural, la neumonía, la insuficiencia respiratoria y los episodios cardiovasculares. Otras complicaciones fueron 6roturas durales (4de ellas en hernias con invasión del ligamento común posterior), un error de nivel (al día siguiente fue operado del disco correcto), 2reoperaciones por persistencia de fragmentos discales y 3pacientes que requirieron instrumentación y fusión tras la primera cirugía. Respecto a la instrumentación, solo se realizó inicialmente en pacientes que fueron sometidos a discectomía de 2 o más niveles (7casos) y en aquellos casos donde consideraron que la corpectomía parcial realizada para llevar a cabo de una forma segura la discectomía fue significativa (7casos). En el resto de casos sistemáticamente se utilizó injerto autógeno proveniente de costilla para rellenar el defecto óseo realizado en la cirugía. Se comparó además el número de complicaciones con el grupo de pacientes que fueron sometidos a una toracotomía en el mismo período (39pacientes) y se observó que el número de neuralgias intercostales que requirieron narcóticos, la estancia hospitalaria, la duración del tubo de drenaje, el sangrado intraoperatorio y la necesidad de transfusión fueron significativamente mayores en este último grupo.
Bartels y Peul5, tras estudiar los resultados de una serie de 14pacientes tratados mediante mini-toracotomía y 7 mediante toracoscopia, concluyen que ellos prefieren el primer abordaje debido a que los resultados clínicos son similares, importándoles más el resultado a largo plazo que no el inmediatamente posquirúrgico. Otras razones argumentadas son la elevada curva de aprendizaje necesaria para realizar una intervención toracoscópica con garantías, el número mínimo de cirugías de este tipo que ha de realizar un cirujano para no solo adquirir la habilidad necesaria sino también para mantenerla, y el elevado coste del material necesario. Argumentan que la mini-toracotomía es un abordaje cuyo aprendizaje es más fácil, con un uso de las técnicas microquirúrgicas similar al del resto de técnicas neuroquirúrgicas, y que permite incluso un manejo de la lesión con más posibilidades que el del abordaje toracoscópico, siendo también a la vez una técnica mínimamente invasiva, con una incisión de entre 4 y 6cm. Combinando estas ideas, se ha publicado la utilización de la toracoscopia combinándola posteriormente con un separador tubular que, sin ampliar la incisión del portal de trabajo, permita utilizar posteriormente el microscopio para resecar el disco intervertebral lesionado6.
Mielopatía agudaSe ha demostrado el valor de la VATS en las hernias torácicas con mielopatía aguda. En una serie de 209 pacientes intervenidos por hernia discal torácica7 (179de ellos mediante toracoscopia), 8de ellos (el 4%) comenzaron con una mielopatía aguda que se tradujo en diferentes déficits neurológicos (grado de Frankel C o peor). Todos ellos fueron tratados mediante exéresis toracoscópica microquirúrgica, monitorización exhaustiva de la presión arterial y protocolo con administración de metilprednisolona. Varias de las características asociadas a estas hernias que causan mielopatía aguda es que suelen ser gigantes, calcificadas, acompañadas de cierto grado de mielomalacia y situarse entre los niveles T9-T10 y T11-T12. Cinco de los pacientes intervenidos alcanzaron un grado Frankel E y 3 un grado D, y todos ellos conservaron la deambulación y la función de los esfínteres. Las complicaciones fueron un sangrado intraoperatorio mayor de 1.000ml, un caso de subíleo postoperatorio, un déficit neurológico transitorio y 2roturas durales que se trataron mediante una combinación de parche hemostático, grasa autógena y cola de fibrina, seguido de la utilización de un drenaje lumbar externo y reposo en cama durante 5días, evitando además la presión negativa en el drenaje torácico.
Consideraciones anatómicasUna importante diferencia entre las vértebras torácicas y las vértebras lumbares y cervicales es la existencia de costillas articuladas con las primeras. Excluyendo a la primera vértebra torácica, cada costilla articula mediante las carillas costovertebrales a nivel craneal y caudal de cada cuerpo vertebral adyacente. Debido a su disposición anatómica, la cabeza de la costilla cubre el espacio discal dorsal así como el pedículo ipsilateral. Por este motivo, la resección de la cabeza de la costilla adyacente es una de las claves para acceder al nivel discal de interés.
El paquete formado por la raíz del nervio y los vasos segmentarios del nivel de interés discurren caudalmente a la cabeza e internamente a través de un surco a lo largo de la cara caudal de la costilla. Con el canal espinal abierto, los bordes dorsales de la mayoría de las vértebras presentan una forma cóncava, lo que se puede comprobar preoperatoriamente mediante la tomografía axial computarizada (TAC). En una visión fluoroscópica lateral la pared del muro posterior es creada por un efecto de adición, siendo la parte cóncava del muro posterior la línea ventral a esta línea.
Posición del paciente y confirmación del nivel de la lesiónEl lado para efectuar el abordaje se elige teniendo en cuenta la localización de la hernia discal y de los grandes vasos adyacentes. En los casos de localización central o con componente lateral derecho se prefiere el abordaje desde el lado derecho. La confirmación del nivel quirúrgico puede ser muy difícil previamente al inicio de la cirugía. Antes de la intervención es recomendable realizar una radiografía lateral torácica para localizar dicho nivel. Los osteófitos significativos que se hayan advertido previamente en las radiografías o en la TAC pueden ser utilizados como marcas quirúrgicas o radioscópicas. Antes de la cirugía, para marcar los portales, y tras empezar esta, mediante una aguja insertada que marque el nivel, es recomendable que fluoroscópicamente se cuenten las vértebras y costillas empezando caudalmente. Hay que prestar atención para localizar pacientes con un número anormal de costillas. Otra opción es marcar el nivel percutáneamente mediante fluoroscopia en 2planos y un objeto metálico que permanecerá adyacente al pedículo de interés para poder así servir de guía a lo largo de toda la cirugía8. Es posible realizar además una mielografía intraoperatoria que indique el máximo nivel de estenosis de canal producido por la hernia. Una vez estamos seguros del nivel, se marca mediante coagulación la costilla adyacente al disco de interés o bien se coloca una aguja guía.
Técnica quirúrgicaEn la mayoría de casos recomendamos realizar una instrumentación tras la discectomía con la intención de evitar una posible inestabilidad producida tras resecar la hernia torácica y la corpectomía parcial necesaria para ello. De no ser así, en los casos donde hubiese inestabilidad podría aparecer dolor y/o deformidad. El cirujano puede considerar que no es necesario o apropiado instrumentar tras la discectomía, y esto puede ser así en casos donde la corpectomía parcial realizada haya sido mínima y en un nivel alto, o porque la implantación del sistema de instrumentación pueda suponer un mayor riesgo que beneficio al paciente.
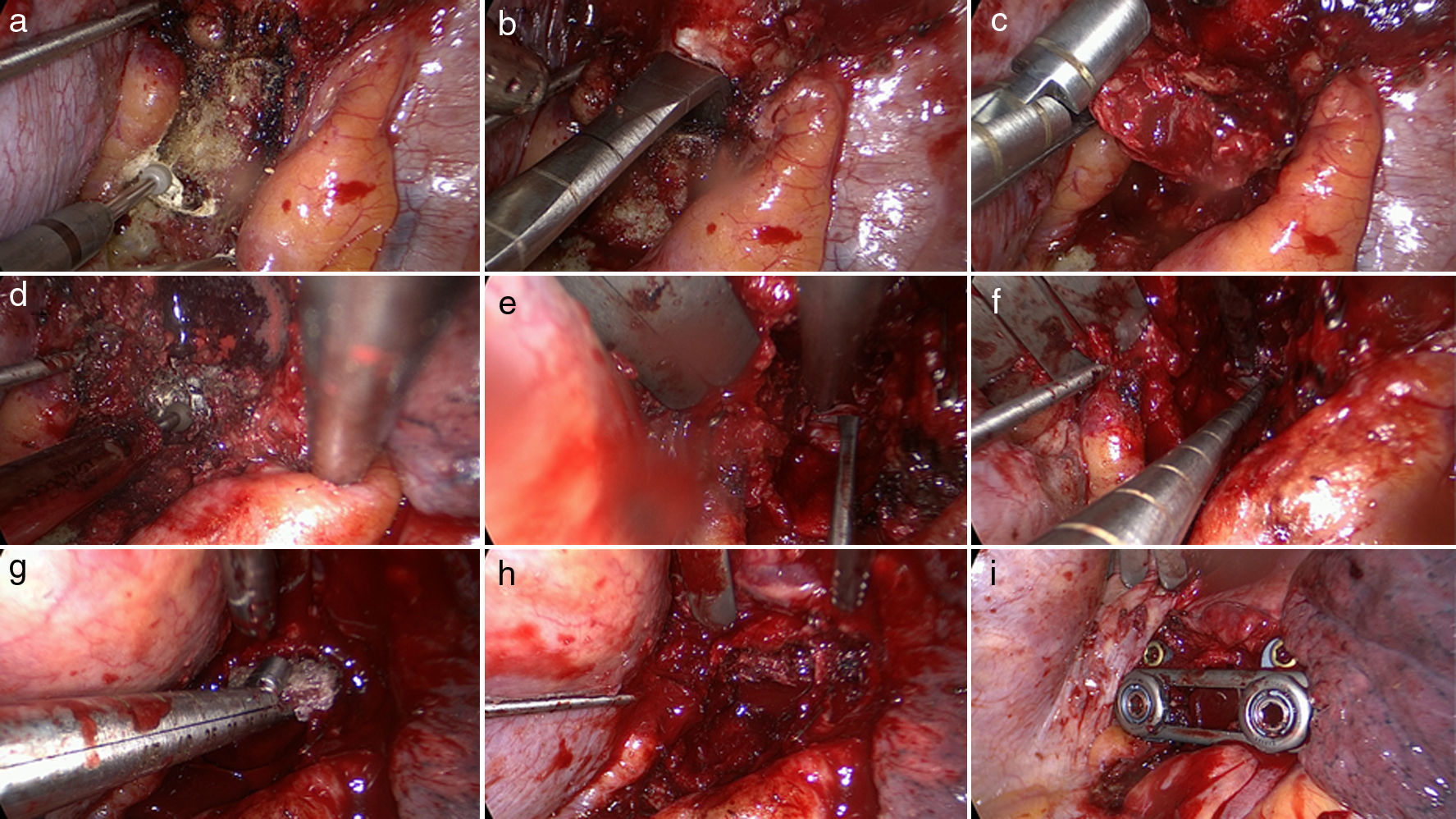
Desde el principio de la cirugía se prepara la colocación del sistema de instrumentación mediante placa atornillada9. Tras colocar las agujas guía con radioscopia en las vértebras adyacentes al disco enfermo se prepara la pared lateral de los cuerpos laterales y el disco mediante coagulación y disección subperióstica con legra de Cobb. Los vasos segmentarios se preparan, y al menos los de la vértebra inferior son ligados con clips metálicos y, tras ello, cortados. Si hiciera falta movilizar la aorta, los vasos segmentarios son disecados, ligados y cortados en varios niveles. Tras delimitar mediante coagulación el extremo proximal de la costilla, este se expone mediante legrado y justo por debajo de la cabeza se fresa (fig. 1a). Luego se utiliza un disector de Cobb para cortar y separar las estructuras capsulares y ligamentosas (fig. 1b) y posteriormente se termina extrayendo el fragmento (fig. 1c). El pedículo se expone mediante una legra que subperiósticamente desplaza los tejidos y empuja la raíz nerviosa dorsalmente sin necesidad de disecar esta del resto de partes blandas. El margen inferior del pedículo se identifica mediante un disector de gancho, y tras adelgazar la cortical externa y parte de la esponjosa mediante fresa de diamante (fig. 1d), se acaba de resecar el pedículo mediante un laminótomo, exponiendo el disco intervertebral afectado. Mediante fresado y osteótomo se realiza un defecto bien definido en los tercios superior e inferior de los cuerpos vertebrales adyacentes al disco, respetando inicialmente la pared posterior de los cuerpos vertebrales.
a)Exposición del extremo proximal de la costilla mediante legrado; el fresado se realiza por debajo de la cabeza. b)Disección y separación de las estructuras capsulares y ligamentosas de la cabeza de la costilla. c)Extracción del fragmento. d)Fresado del pedículo adyacente al nivel patológico. e,f)Disección de la parte herniada del disco, que con disector y cuchara se empuja muy cuidadosamente alejándolo de la duramadre hacia el defecto vertebral creado. g,h)El fragmento de costilla extraído es utilizado para realizar una fusión monosegmental en el defecto creado. i)Sistema de placa atornillada de estabilización ventral-lateral MACS TL.
Una vez tenemos visualizada la duramadre, se diseca y se separa cuidadosamente la pared posterior de los cuerpos vertebrales, apartándola hacia la zona del defecto creado, donde se reseca. Cuando se ha hecho esto, se diseca la parte herniada del disco, que se empuja muy cuidadosamente hacia el defecto vertebral mediante disector y cuchara (fig. 1e,f). En caso de existir una hernia intradural calcificada ha de realizarse todavía más si cabe una delicada disección de esta para separarla del espacio subaracnoideo. Si no es posible realizar esto último sin lesionar la duramadre, puede adelgazarse la base de la hernia calcificada con la fresa de diamante dejando una mínima capa que no tendrá ningún efecto compresivo. Tras realizar una completa descompresión, se confirma esta con visión endoscópica directa y mediante disector de gancho y fluoroscopia. La duramadre es recubierta con esponja de gelatina absorbible o con una malla de colágeno. El fragmento de costilla extraído será utilizado para realizar una fusión monosegmental en el defecto creado (fig. 1g,h), utilizándose además cuando sea preciso el sistema de placa atornillada de estabilización ventral (fig. 1 y fig. 2).
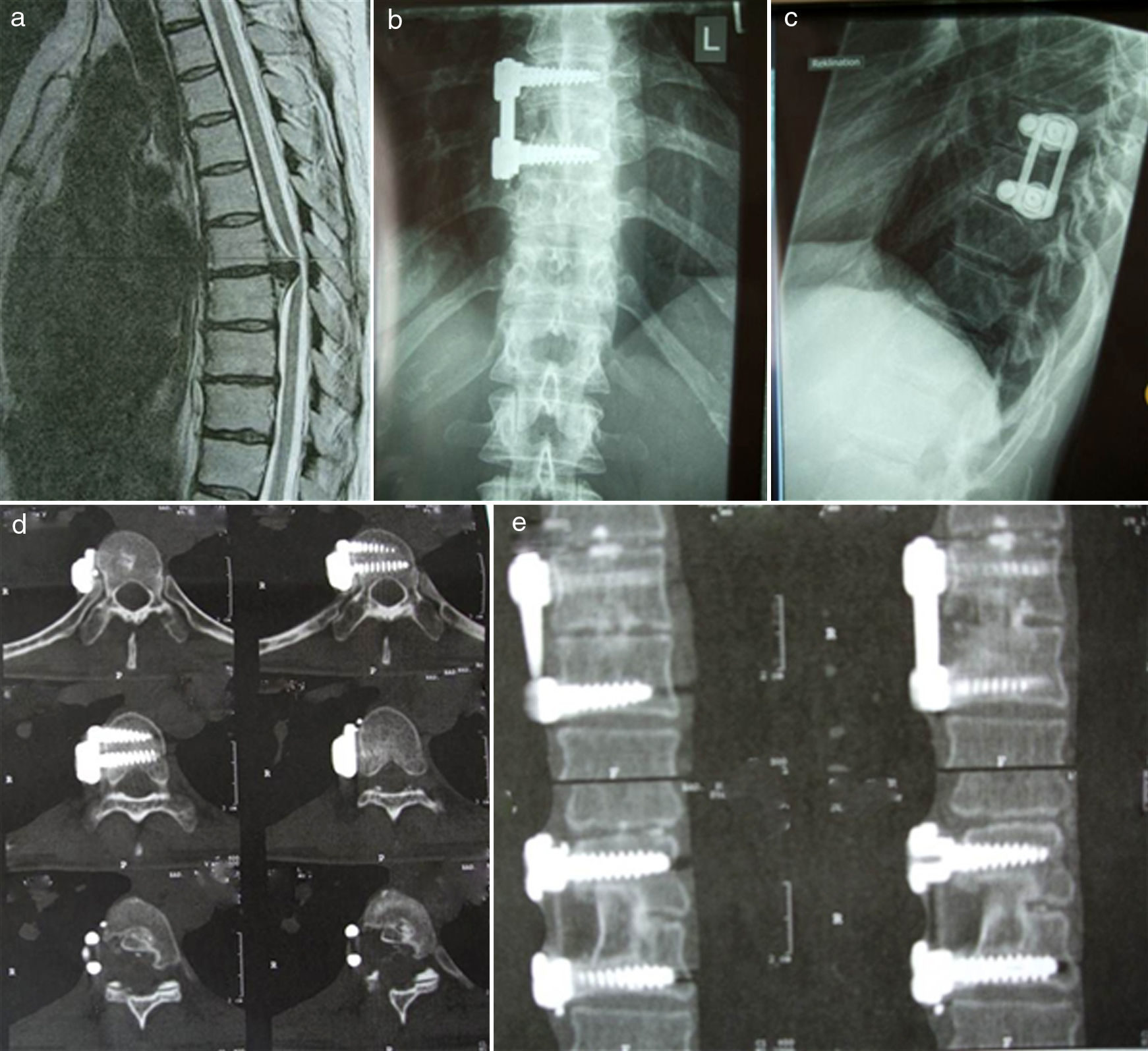
Caso clínico de una mujer de 34años que desde hace meses presenta debilidad progresiva en los miembros inferiores acompañada de ataxia y que ingresa de urgencia tras el deterioro agudo, con afectación de esfínteres y dolor torácico en cinturón. a)Corte sagital de resonancia magnética que demuestra hernia discal extruida calcificada T8-T9. b,c)Las radiografías postoperatorias muestran el resultado quirúrgico a los 6meses de realizar la discectomía mediante abordaje toracoscópico y la artrodesis conseguida mediante injerto autógeno óseo con fragmento de costilla y sistema de placa de estabilización MACS TL. La paciente se recuperó totalmente del déficit neurológico. d,e)La tomografía computarizada posquirúrgica muestra la artrodesis obtenida.
El tratamiento quirúrgico estándar de la escoliosis se basa en el abordaje posterior, que en el momento actual se apoya en construcciones mediante barras y tornillos transpediculares o construcciones híbridas con tornillos, ganchos y alambres10. En los últimos años se ha incrementado el número de trabajos publicados acerca de diferentes series de pacientes afectados de escoliosis u otras deformidades tratados mediante cirugía toracoscópica bien como procedimiento único o combinado con otro abordaje posterior11–24. La mejor indicación para la VATS es su aplicación en casos de escoliosis primaria o idiopática del adolescente (AIS) con curvas primarias únicas torácicas con patrón de Lenke tipo IA o IB y sin aumento de la cifosis, estando contraindicada en escoliosis de doble curva mayor y en pacientes que no puedan tolerar la ventilación selectiva de un solo pulmón25. Muy recientemente se ha publicado un trabajo en el que un grupo de 24mujeres con AIS y curvas torácicas derechas con patrón de Lenke tipo IC fueron tratadas mediante VATS y donde el ángulo de Cobb de la curva lumbar compensadora se corrigió espontáneamente, pasando de una media de 43,5 a 25,4° medidos 2años después de la cirugía26.
En una revisión realizada por Reddi et al.27 publicada en 2008 se acabó concluyendo que el grado de corrección de las curvas mediante instrumentación torácica anterior por toracoscopia era comparable al alcanzado mediante abordajes posteriores o anteriores abiertos convencionales. El mismo trabajo destacaba que la ventaja de un abordaje menos agresivo y con mejores resultados estéticos tenía en contra, sin embargo, un aumento del tiempo quirúrgico y de la estancia en cuidados intensivos a la vez que una elevada tasa de complicaciones, sobre todo referente a fallos en la instrumentación y seudoartrosis en algunas de las series. En este último punto, y para evitar la morbilidad que supone la extracción de hueso iliaco autógeno, Weinzapfel et al.28 han demostrado en un trabajo retrospectivo la utilidad de la matriz ósea desmineralizada en la cirugía toracoscópica de la escoliosis.
En un estudio retrospectivo con 52pacientes tratados quirúrgicamente mediante abordaje posterior o toracoscópico por curvas Lenke tipo i donde se realizaron cuestionarios, Lonner et al.29 encontraron una mayor puntuación en los dominios de autoestima y salud mental en los pacientes tratados mediante toracoscopia, mostrando el análisis por grupos una mejoría no significativa en la mayoría de los dominios de las encuestas y una tendencia en la puntuación total que tendía a la significación. La magnitud de la corrección total de la curva no difería entre los grupos, y el grado de complicaciones fue similar.
Norton et al.16 obtuvieron magníficos resultados en una serie de 45pacientes con buenos datos respecto a niveles de corrección de curvas, satisfacción y estancia hospitalaria (entre otros), y solamente 3 complicaciones: un caso con disestesias en la pared torácica, que se resolvió en 3meses, y 2casos de atelectasia posquirúrgica. No hubo fallos en la artrodesis, y con un seguimiento medio de 4,6años todas las curvas mantuvieron el grado de corrección. Newton et al.20 han publicado una serie de 41pacientes con buenos resultados de corrección de curvas y de fusión (97% de los segmentos instrumentados) pero con 3casos de rotura de barra y 3pacientes que requirieron una revisión quirúrgica por vía posterior. Concluyeron en su trabajo que había que tener en cuenta el riesgo de seudoartrosis, fallo de la instrumentación y la revisión quirúrgica contraponiéndolos a las ventajas de una limitada disección muscular y una mejor apariencia cosmética del abordaje por VATS, defendiendo este último como una alternativa quirúrgica viable en el tratamiento de las deformidades.
En otra serie prospectiva de 100 pacientes tratados mediante toracoscopia15 se correlacionaron los resultados clínicos (mediante la utilización de cuestionarios) con las medidas radiográficas y se encontraron resultados muy similares a estudios previos basados en cirugías con abordajes posteriores. Se vio además que había un mayor grado de satisfacción en los pacientes que presentaron una mayor disminución del ángulo de Cobb. El 13% de los pacientes presentó una rotura de la barra (siempre después del primer año y de manera asintomática) y el 10% tuvieron problemas con los tornillos o tuercas (en estos casos en el período postoperatorio temprano), aunque no hubo una correlación entre las complicaciones y el grado de satisfacción. En otro trabajo30 donde se comparaba 17pacientes operados mediante toracoscopia con una cohorte control, intervenida mediante por vía posterior, emparejada por sexo, edad y grado de magnitud de curva, se apreció una diferencia a favor del primer grupo con respecto al sangrado intraoperatorio y sin diferencias con respecto al tiempo quirúrgico, el grado de corrección de la curva (tanto en el postoperatorio como en el seguimiento), las complicaciones y los resultados funcionales valorados mediante encuestas. Longis et al.19 estudiaron si al añadir un procedimiento anterior toracoscópico a un abordaje posterior había cambios en el balance sagital, y los resultados fueron que no hubo cambios en el ángulo de Cobb ni en el plano sagital ni coronal, aunque sí se produjo una corrección adicional de 15,5° (23%) de la hipercifosis torácica en los pacientes que presentaban cifoescoliosis.
Por último, en otro trabajo publicado por Lonner et al.21 donde se comparaba el abordaje toracoscópico con el abordaje posterior con tornillos pediculares se vio que en pacientes con una única curva torácica de menos de 70°, normo o hipocifótica, los resultados radiográfico y clínico y el grado de complicaciones fueron similares, con la excepción de una mejoría en la corrección de la curva en el segundo grupo (57,3% contra 63,8%; p=0,08). Se citaron como ventajas de la VATS una disminución del sangrado intraquirúrgico, un mejor resultado cosmético y un menor número de niveles fusionados, llegando a preservar de la instrumentación casi un nivel en la parte caudal. A nivel negativo, destacó un aumento del tiempo quirúrgico y una mínima desventaja respecto a la capacidad respiratoria (que se tradujo como una ganancia mayor del flujo respiratorio pico a los 2años en el segundo grupo).
Puede ser de utilidad complementar el abordaje toracoscópico estándar mediante mini-toracotomías o mini-lumbotomías16,18. Se ha comparado también la cirugía toracoscópica con la cirugía mediante mini-toracotomía más portales para uso de toracoscopio. En un estudio aleatorizado13 se obtuvieron similares resultados respecto a la corrección de las curvas en ambos grupos pero con ligeras ventajas significativas en el grupo de la mini-toracotomía asistida respecto al tiempo operatorio, a la pérdida de sangre quirúrgica, al débito en el drenaje postoperatorio y a la pérdida temprana de la corrección previamente alcanzada. Se ha demostrado también que la precisión en la localización de los tornillos colocados mediante toracoscopia es comparable a la obtenida mediante mini-toracotomías12.
También se ha descrito la utilidad de la cirugía toracoscópica para realizar toracoplastias con el fin de disminuir la deformidad de la giba en un primer tiempo y la realización de la corrección y fusión por vía posterior en un segundo tiempo17, pero como se describirá a continuación, hay que tener en cuenta que la realización de una toracoplastia va a ir acompañada de una disminución de la capacidad ventilatoria. Respecto a la enfermedad de Scheuermann, en un trabajo retrospectivo11 que incluía 11pacientes tratados mediante abordaje posterior con osteotomía de Ponte31 y artrodesis transpedicular comparados con 11pacientes tratados además con liberación anterior discal por VATS, no se encontraron diferencias significativas entre los grupos. El trabajo concluía que no era necesario realizar un procedimiento anterior con una adecuada construcción mediante tornillos pediculares y osteotomías de Ponte en el ápex de la cifosis.
La función respiratoria es siempre un factor a considerar en la escoliosis. En un trabajo prospectivo con 254pacientes32 se vio que a los 2años de la cirugía había un pequeño empeoramiento en las pruebas respiratorias relacionado con los abordajes anteriores abiertos. La cirugía posterior y la toracoscopia tuvieron sin embargo un menor efecto en dicha función, y es de destacar que el factor predictivo más importante era el grado de afectación previo a la cirugía. En otro estudio prospectivo de 107 pacientes33 se puso de manifiesto que a los 2años de la cirugía los pacientes tratados mediante toracoscopia presentaban mejores parámetros ventilatorios que los tratados mediante toracotomía abierta (los resultados todavía empeoraban más si se había realizado algún procedimiento de toracoplastia). En otro estudio prospectivo de diseño parecido34 se obtenían similares resultados, pudiendo añadir que había deterioro de la función ventilatoria si al procedimiento toracoscópico se añadía una toracoplastia y destacando además que en los pacientes con escoliosis toracolumbar y con disrupción quirúrgica del diafragma no había empeoramiento significativo. Curiosamente, en un último trabajo con 159pacientes35 divididos en 4grupos (abordajes abierto anterior, abordaje posterior, instrumentación mediante toracoscopia y abordaje posterior más toracoscopia) se observó en los pacientes sometidos a procedimientos toracoscópicos una disminución inicial postoperatoria de las medidas de función respiratoria al compararse con los abordajes abiertos anterior y posterior, pero esta diferencia desaparecía entre los 6 y los 12meses de seguimiento. Además, los pacientes presentaban una recuperación total o casi total de la función respiratoria a los 6meses de la realización de cirugías abiertas anteriores o toracoscópicas.
Técnica quirúrgicaLa posición quirúrgica del paciente es en decúbito lateral estricto con el lado cóncavo de la curva abajo. Aunque siempre depende de la morfología de la curva, el primer portal suele situarse en el sexto o séptimo espacio intercostal, en proyección con la columna vertebral, y se ajusta según la rotación de esta. Se suelen utilizar 2portales más de trabajo 2espacios por encima y por debajo, aunque podría ser necesario utilizar alguno más. La pleura se diseca longitudinalmente a lo largo de toda la longitud de la columna vertebral que vaya a ser fusionada, disecándose y ligando los vasos segmentarios y exponiéndose el área comprendida entre la cabeza de las costillas y el ligamento común anterior vertebral. Se realiza entonces la discectomía completa de los niveles a fusionar. Una vez se ha resecado todo el disco, se adelgaza desde el espacio intervertebral y de manera cuidadosa el ligamento común anterior, disminuyendo así su resistencia pero respetándolo con la intención de que contribuya a alojar el injerto óseo que se coloque posteriormente. Los platillos vertebrales se refrescan hasta llegar al hueso subcondral. En cada disco se comprueba mediante control radioscópico y con ayuda de un gancho que se ha realizado por completo la discectomía, y tras ello se utiliza cualquier material hemostático, que se dejará en el espacio intervertebral hasta la colocación del injerto.
Una de las claves de la cirugía es realizar una completa discectomía y exéresis de las plataformas vertebrales para conseguir una adecuada fusión en los niveles deseados. Posteriormente se procede a disecar subperiósticamente las costillas a lo largo de estas todo lo que permita el abordaje con la intención de realizar 2incisiones parciales de alrededor de 10cm y extraer un injerto de la mitad del grosor de la costilla. Esto permite salvar la integridad de la caja torácica, teniendo en cuenta que además se respeta la capacidad regenerativa del periostio. El proceso se repite tantas veces como hueso se necesite para rellenar todos los espacios intervertebrales y se realiza después de las discectomías, debido a que durante las primeras es mejor tener una caja torácica más estable, con lo que se evitan posibles fracturas que se producirían por las diferentes maniobras quirúrgicas.
La aguja guía del tornillo se colocará en el centro del cuerpo vertebral, justo anterior a la cabeza de la costilla, y con control radioscópico se procederá a realizar una ligera inclinación de la aguja desde posterior a anterior, evitando así el canal espinal y paralela a los platillos vertebrales. Una vez asegurada la trayectoria se procede a la introducción de la aguja hasta la cortical contralateral y se vuelve a comprobar con control fluoroscópico. Sobre la aguja se dispone un punzón para romper la cortical y seguidamente se inserta el tornillo con una longitud apropiada hasta la cortical contralateral, siempre con control radiográfico. Es muy importante que la cabeza del tornillo quede a la misma altura en cada vértebra, lo que facilitará posteriormente en gran medida la reducción de la deformidad. En ese sentido, también ayudará mucho el haber colocado cada tornillo justo delante de las cabezas de las costillas.
Qiu et al.14 han realizado un trabajo de medición de las relaciones entre la aorta, los cuerpos vertebrales y la cabeza de las costillas comparando un grupo de sujetos sanos con otro grupo de pacientes con escoliosis idiopática del adolescente con curvas torácicas derechas donde la aorta se desplaza más posteriormente y se acerca más al cuerpo vertebral, debido a la rotación existente en la columna y a la anomalía en el plano vertical. Acabaron concluyendo que en las vértebras más cefálicas (T4-T6) el ángulo ideal máximo ventral de entrada del tornillo debería disminuir gradualmente de 20 a 5°, con el punto de entrada justo delante de la cabeza de las costillas y con una longitud del tornillo de 25mm. En las vértebras apicales (T7-T9) este ángulo aumentaría gradualmente de 5 a 12°, con el mismo punto de entrada y una longitud de 30mm, y en las vértebras caudales (T10-T12) el ángulo seguiría aumentando, desviando unos 3-5mm ventralmente el punto de entrada y con una longitud óptima del tornillo de 35mm. Esta información es orientativa y no debe excluir la realización de un estudio preoperatorio de la TAC para realizar un examen preciso de la anatomía real de cada paciente y determinar la longitud más adecuada para cada tornillo según el nivel, sin olvidarnos además de la importancia de colocar estrictamente en posición lateral al paciente y del control radiológico intraoperatorio en cada maniobra sustancial.
Tras la colocación de todos los tornillos se procede a rellenar cada espacio intervertebral con el injerto. Primero se coloca una pequeña cantidad que se va apelmazando poco a poco, para ir así repitiendo el proceso hasta que todo el espacio está debidamente relleno. Tras ello se deja caer el periostio previamente disecado sobre las vértebras. Es posible utilizar también injerto de hueso iliaco autógeno, aloinjerto de hueso de banco (p.ej., anillos de hueso femoral que pueden rellenarse con el hueso proveniente de las costillas) o cajas sintéticas o metálicas que también pueden rellenarse. El siguiente paso es la medición de la barra que vayamos a insertar, y para ello puede utilizarse una barra medidora deformable que se coloca entre los tornillos más distales. Tras cortar la barra con la longitud requerida, esta se introduce por el segmento inferior sin doblarse, luego se fija al tornillo más inferior y progresivamente se va introduciendo superiormente en los demás tornillos, fijándola a estos parcialmente. Posteriormente se realiza la compresión en cada segmento, empezando de nuevo desde el segmento inferior, reduciéndose la curva. Existen en el mercado sistemas que permiten la colocación de 2barras. La segunda barra, una vez colocada la primera, es más fácil de situar debido a la alineación que ya presentan las vértebras y el resto del sistema. Hasta L3 puede ser instrumentado por un abordaje toracoscópico, pero es posible utilizar además una lumbotomía lateral mínima asistida con endoscopio y con exposición retroperitoneal para el manejo e instrumentación de las primeras vértebras lumbares si así se prefiere o si las características anatómicas del paciente son más propicias para ello.
Tratamiento de las lesiones tumoralesExiste un amplio espectro de lesiones benignas y malignas (primarias o secundarias) que pueden afectar la columna vertebral torácica y lumbar. Respecto a las lesiones epidurales metastásicas, estas suponen un número importante debido a que hasta el 10% de los pacientes con cáncer tendrá lesiones de este tipo36, estando el 70% de ellas localizadas en la región torácica y el 20% en la región lumbar con una disposición la mayoría de las veces ventral, en el cuerpo vertebral o en el espacio epidural anterior. El tratamiento adecuado para cada lesión de este tipo puede resultar un auténtico desafío y requiere una colaboración interdisciplinar, por lo que cada paciente recibirá una terapia individualizada que tendrá en cuenta, entre otros múltiples factores, la estabilidad de las estructuras, la compresión neurológica, la radiosensibilidad del tumor, el dolor y el pronóstico general37. Dentro de las indicaciones para el tratamiento quirúrgico se incluyen el dolor intratable causado por deformidad o inestabilidad espinal, el compromiso severo del canal espinal y el déficit neurológico progresivo. Así pues, la cirugía toracoscópica puede estar indicada en el tratamiento de algunas de estas lesiones, evitando la mayor agresión que supone un abordaje anterior abierto en pacientes que ya de por sí pueden tener otras comorbilidades y que además pueden recibir posteriormente tratamiento con radioterapia.
Kan y Schmidt38 han publicado los buenos resultados de su experiencia preliminar con cirugía toracoscópica en una serie de 5pacientes con lesiones metastásicas en la región toracolumbar. El abordaje y el tratamiento utilizados fueron similares al manejo de una fractura que requiriese una corpectomía con descompresión del canal más estabilización mediante placa ventral y caja expansible. La técnica toracoscópica puede además utilizarse para completar otro abordaje39, destacando su uso en la resección de tumores torácicos en forma de reloj de arena40, la mayoría de ellos de origen neurogénico y que según cada caso pueden distribuirse en la cavidad torácica y los forámenes neurales, invadiendo la vértebra, el canal espinal o la región paravertebral.
Destaca en este sentido el uso de la hemilaminectomía combinada con la toracoscopia para conseguir una completa y segura resección tumoral. No obstante, tumores de este tipo con una mínima extensión intraforaminal o en el canal espinal pueden ser resecados solo mediante toracoscopia41,42, la cual puede beneficiarse de la combinación con un sistema de navegación de imágenes43. Las desventajas que podemos destacar del abordaje VATS en la resección tumoral es que no ofrece acceso a los elementos posteriores de la vértebra, accediendo solo a una pequeña parte del pedículo contralateral, por lo que un abordaje posterior sería más adecuado para una lesión que produjera una compresión circunferencial. Si existiera una deformidad mayor, sería necesario realizar una intervención posterior con el fin de reducir y estabilizar de manera más adecuada la columna. Por otra parte, otro inconveniente es que el manejo de complicaciones intraoperatorias como el sangrado importante o la rotura dural es técnicamente más difícil y complejo.
Simpatectomía mediante toracoscopiaLa simpatectomía mediante cirugía toracoscópica es un procedimiento bien establecido que ha demostrado su valor terapéutico en procesos como la hiperhidrosis44, el enrojecimiento facial45, la angina cardíaca46 y otras enfermedades como la distrofia simpático-refleja y la enfermedad de Raynaud47. La indicación más frecuente de la simpatectomía es la hiperhidrosis y, como en los otros procesos, suele realizarse la intervención tras demostrarse un mal resultado del tratamiento médico o de otras terapias.
En la angina de pecho puede estar indicado realizar una simpatectomía bilateral a los pacientes no subsidiarios de ser tratados mediante cirugía derivativa o procedimiento endovascular tras realizar una arteriografía coronaria, o a los pacientes refractarios al tratamiento médico. Las complicaciones quirúrgicas de la simpatectomía mediante videotoracoscopia pueden ser diversas, destacando como la más frecuente la hiperhidrosis compensatoria, que sucede en diferentes partes del cuerpo y que, según las series, oscila entre el 20 y el 86%48. Se han realizado múltiples trabajos comparando la disminución de la hiperhidrosis palmar y axilar y la aparición de hiperhidrosis compensatoria según los niveles donde se ha realizado la simpatectomía (T2, T3, T4 y diferentes combinaciones de estos) y los resultados son muy heterogéneos respecto a la hiperhidrosis compensatoria, demostrándose en prácticamente todos ellos efectividad a la hora de reducir la hiperhidrosis palmar y/o axilar47,48.
Técnica quirúrgicaEl material quirúrgico utilizado para realizar la simpatectomía puede ser diferente al utilizado en las cirugías previamente descritas, con un menor diámetro del instrumental además de poder realizarse incisiones más pequeñas. Para la realización de esta técnica se puede recurrir al toracoscopio con canal de trabajo, el cual nos permitirá realizar toda la intervención a través de un único puerto. Se coloca al paciente en posición de semi-Fowler, con los brazos en abducción. En el manejo anestésico y ventilatorio puede utilizarse la intubación selectiva o bien la realización de apneas momentáneas cuando se requiera el colapso del pulmón del hemitórax sobre el que se trabaja. Se realiza una única incisión a nivel del 3.er-4.o espacio intercostal, tomando para ello como referencia, a nivel de la línea axilar media, la línea de nacimiento del vello axilar. Se localiza la cadena simpática, con los ganglios protruyendo a la altura de las cabezas de las costillas. Se accede al nivel deseado, se diseca y localiza el nervio y se secciona mediante electrocoagulación. Ciertos autores abogan por el clipado del nervio en vez de la sección del mismo, por la posible reversibilidad del proceso49, si bien esta no ha sido fehacientemente demostrada50.
En lo que respecta al nivel a tratar, se referencia según el número de costilla sobre el que se encuentra, siendo por ejemplo el primer nivel R1, el segundo R2, y así sucesivamente. No existen claras evidencias en lo que respecta a qué nivel es el que presenta una mejor eficacia y una menor tasa de efectos secundarios, en especial sudoración compensadora, pero lo que sí es generalmente aceptado por todas las guías es únicamente seccionar el R2 para el tratamiento del rubor facial, recomendándose para el resto de indicaciones el tratamiento sobre R3 a R544,51. Se han localizado vías accesorias (el llamado nervio de Kuntz), clásicamente a nivel R2, por lo que se recomienda realizar electrocauterio unos 2-3cm sobre la costilla para evitar la permanencia del mismo. En el trabajo de McCormack et al.52 localizaron este nervio en el 66% de los pacientes a nivel R2, en el 32% a nivel R3 y en el 13% en R4.
Tratamiento de las infeccionesExiste la posibilidad de tratar endoscópicamente la discitis y la espondilodiscitis53. Antes de la operación puede realizarse una punción guiada por TAC para tomar muestras y realizar cultivos con la intención de descubrir el microorganismo responsable y así poder aplicar el antibiótico más adecuado tanto a nivel sistémico como a nivel local durante la cirugía. Los vasos sanguíneos pueden también en este caso verse alterados tanto en la localización como en su morfología debido al tejido inflamatorio circundante, y por ello es necesario estudiar su localización preoperatoria así como descartar su posible rotura preoperatoria o la formación de seudoaneurismas.
Los principales objetivos de la intervención serán por una parte la limpieza y el desbridamiento de los tejidos afectados por el proceso infeccioso e inflamatorio, y por otra, la estabilización de la columna mediante la precisa reconstrucción de esta (fig. 3). La opción toracoscópica puede, pues, representar una adecuada alternativa para pacientes con procesos destructivos secundarios a espondilodiscitis o discitis, sobre todo pacientes de mayor edad o con comorbilidad asociada54. El abordaje y el procedimiento operatorios son esencialmente los mismos que para el tratamiento de las fracturas. El pannus o tejido inflamatorio y el incremento de la vascularización y de las adherencias se traducen en una mayor dificultad para la orientación y la técnica quirúrgica, y por eso es muy importante utilizar lo antes posible las agujas guía bajo control radioscópico. Tras esto se procede a la limpieza y al desbridamiento exhaustivo de los tejidos enfermos y posteriormente se realiza la reconstrucción mediante una caja expansible de titanio acompañada de injerto óseo autógeno y del antibiótico adecuado. Se recomienda realizar además una instrumentación dorsoventral y que vaya más allá de los niveles primariamente afectados para asegurar la estabilidad.
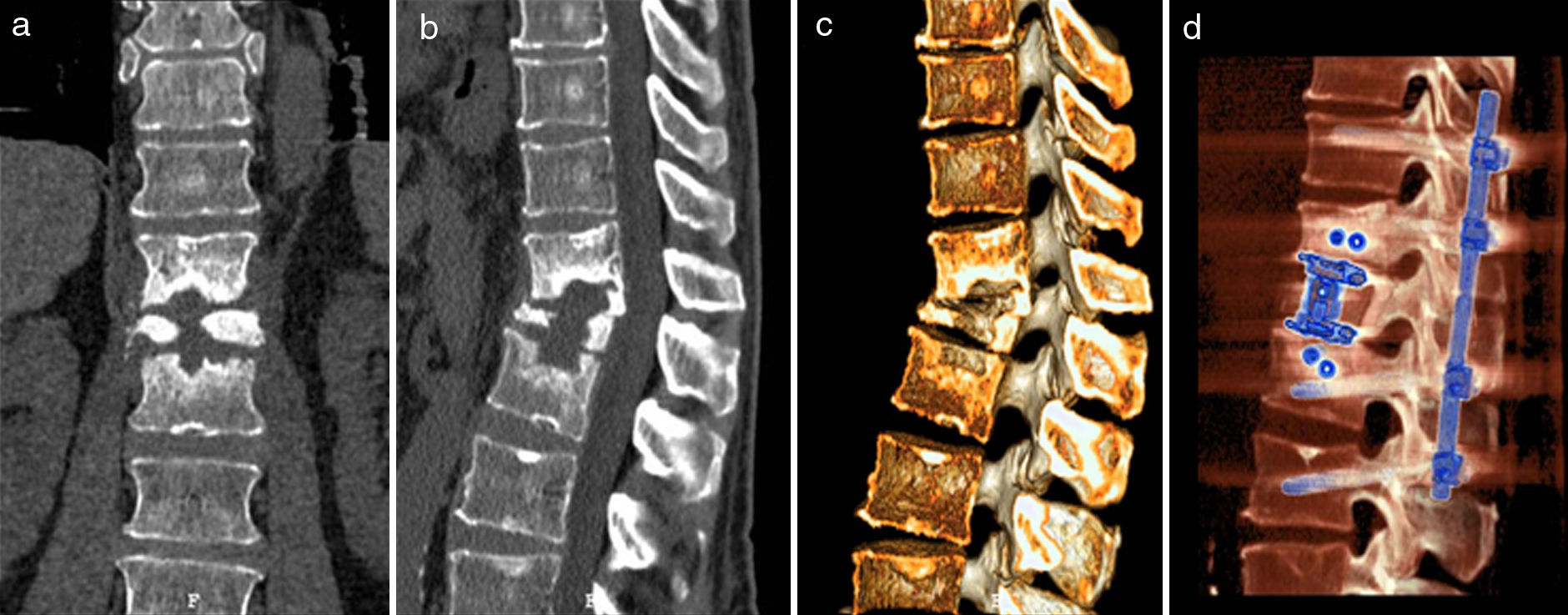
Caso clínico de un hombre de 66años con fractura-aplastamiento de cuerpo vertebral de L1 tratada conservadoramente y complicada con espondilodiscitis por Staphylococcus aureus con aumento de clínica dolorosa y deformidad. a-c)Las imágenes de tomografía axial computarizada (TAC) muestran la osteólisis producida en el cuerpo vertebral de L1, así como en las vértebras adyacentes, además de la deformidad cifótica adquirida. d)La imagen de TAC posquirúrgica muestra la corrección obtenida tras un abordaje posterior con sistema de artrodesis transpedicular T11-T12-L2-L3 seguido de un abordaje anterolateral toracoscópico con corpectomía L1 y sistema de sustitución vertebral expansible Hydrolift más placa de estabilización atornillada en T12 y L2.
La tuberculosis raquídea es una enfermedad grave y que tiene una alta prevalencia en determinadas zonas geográficas. En muchos casos es necesario combinar el tratamiento médico basado en las pruebas de laboratorio con un adecuado tratamiento quirúrgico, indicado por complicaciones neurológicas, fallo del tratamiento médico, progresión de las lesiones a pesar del tratamiento médico, prevención de cifosis severa en pacientes con extensas lesiones dorsales, inestabilidad raquídea y/o ante la necesidad de confirmación diagnóstica. El tratamiento quirúrgico puede contemplar el desbridamiento y la evacuación de abscesos, la descompresión, la fusión y la estabilización de la columna vertebral. Lü et al.55 han publicado una serie de 50pacientes con tuberculosis espinal torácica tratados mediante toracoscopia y mini-abordaje con buenos resultados clínicos y con una corrección media de la cifosis del 38,7% que a 5años tuvo una pérdida del 1,3%, sin que se diera ningún caso de recurrencia de la enfermedad. Similares resultados han sido publicados por otros autores56,57.
Indicaciones especialesIncluye cualquier tipo de cirugía primaría (p.ej., la reparación del conducto torácico tras un traumatismo58) o de revisión por diferentes causas: retirada de implante, infección secundaria, fallo o pérdida de implante, pudiendo ser la cirugía previa a la revisión abierta o toracoscópica. Es importante tener en cuenta la posible existencia de adherencias pleurales (sobre todo tras un gran abordaje abierto), por lo que todavía hay que maximizar el cuidado en los primeros pasos de la intervención a la hora de introducir los trocares y el instrumental. Las adherencias son entonces resecadas mediante disección aguda y roma. Otro factor a tener en cuenta es que debido a las adherencias y al tejido cicatricial, la anatomía puede verse distorsionada, por lo que la orientación quirúrgica queda en este caso dificultada.
ConclusionesEn los últimos años, la evolución de la cirugía toracoscópica del raquis la ha convertido en una alternativa a la cirugía abierta convencional. El uso del abordaje transdiafragmático ha hecho posible el tratamiento endoscópico de gran cantidad de procesos de la unión toracolumbar, ampliándose por ello el espectro de indicación terapéutica que incluye el tratamiento de deformidades, tumores, infecciones y otros procesos patológicos, así como la reconstrucción de los segmentos raquídeos lesionados y la descompresión del canal raquídeo si la disposición de la lesión es favorable al abordaje anterolateral. Los buenos resultados clínicos de la cirugía toracoscópica están avalados por una creciente experiencia plasmada en un elevado número de trabajos. El grado de complicaciones de la cirugía toracoscópica es comparable al de la cirugía abierta, con ventajas respecto a la morbilidad del abordaje y a la recuperación posterior de los pacientes.
Conflicto de interesesRudolf Beisse declara recibir honorarios por parte de Aesculap (Tuttlingen, Alemania) y además ha participado como consultor de Aesculap en el desarrollo de los sistemas de instrumentación MACS-TL e Hydrolift. Francisco Verdú manifiesta no tener conflicto de intereses.