Describir las características radiológicas, quirúrgicas y manejo de la presión intracraneal (PIC) de una cohorte de pacientes con traumatismo craneal grave (TCEG) ingresados en los últimos 25años.
MétodosEstudio observacional de una cohorte consecutiva de pacientes adultos (>14años) con TCEG cerrado (GCS≤8) admitidos en las primeras 48h del TCEG en el Hospital 12 de Octubre entre 1987 y 2012. Se definieron las características radiológicas, los procedimientos quirúrgicos y las indicaciones de monitorización de la PIC y se compararon en los 3 periodos de tiempo (1987-1995, 1996-2004 y 2005-2014).
ResultadosSe apreció un aumento significativo del hematoma subdural mayor de 25cc, de la desviación de la línea media y de la hemorragia subaracnoidea (HSA) en el último periodo de tiempo.
Fueron intervenidos 721 pacientes (39,4%); 585 (81,1%) en las primeras 12h (cirugía precoz). El tratamiento quirúrgico disminuyó significativamente en el último periodo de tiempo, siendo la craniectomía descompresiva (CD) con la evacuación de una masa intracraneal el procedimiento más utilizado en el este periodo.
Se monitorizó la PIC en 1.049 pacientes (57,3%), con una frecuencia significativamente mayor en el segundo periodo, con una adherencia a las Guías del 64,4%. La PIC elevada incontrolable fue significativamente mayor en el primer periodo de tiempo.
ConclusionesComo consecuencia de los cambios epidemiológicos que se han apreciado en los pacientes con TCEG en los últimos 25años, describimos un patrón diferente de lesión morfológica, como se puede apreciar por el cambio en la TC, lo que determina un cambio en la práctica clínica durante este periodo de observación.
To describe the radiological characteristics, surgical indications, procedures, and intracranial pressure monitoring of a representative cohort of severe traumatic brain injury (sTBI) cases collected over the past 25years, and to analyse the changes that have occurred by dividing the period into 3 equal time periods.
MethodsAn observational cohort study was conducted on consecutive adult patients (>14years of age) with severe closed TBI (Glasgow Coma Scale score [GCS]≤8) who were admitted during the first 48hours after injury to the Hospital 12 de Octubre from 1987 to 2012. The most relevant radiological findings, surgical procedures, and intracranial monitoring indications reported in the literature were defined and compared in 3 equal time periods (1987-1995, 1996-2004, and 2005-2014).
ResultsA significant increase was observed in subdural haematomas with lesions over 25cc, and midline shift in the last period of time. The incidence of subarachnoid haemorrhage increased significantly with time. There was a progression to a worse computed tomography (CT) classification from the initial CT scan in 33% of cases.
Surgery was performed on 721 (39.4%) patients. Early surgery (<12hours) was performed on 585 (81.1%) patients, with the most frequent being for extra-cerebral mass lesions (subdural and epidural haematomas), whereas delayed surgery (>12hours) was most frequently performed due to an intracerebral haematoma. Surgical treatment, both early and late was significantly lower with respect to the first time period. Decompressive craniectomy with evacuation of the mass lesion was the preferred procedure in the last time period.
Intracranial pressure monitoring (ICP) was carried out on 1049 (57.3%) patients, with a significantly higher frequency in the second period of time. There was adherence to Guidelines in 64.4% of cases. Elevated/uncontrolled ICP was more significant in the first time period.
ConclusionsAs a result of the epidemiological changes seen in traumatic brain injury, a different pattern of morphological injury is described, as depicted in the CT, leading to a difference in practice during this period of observation.
El perfil epidemiológico y clínico de la cohorte de 1.830 pacientes con traumatismo craneal grave (TCEG) del Hospital 12 de Octubre se ha detallado en una publicación previa1. En esta segunda parte describimos la tendencia en los hallazgos de la tomografía computarizada (TC), indicaciones de la monitorización de la presión intracraneal (PIC) y tratamiento quirúrgico a lo largo de los últimos 25años, divididos en los 3 periodos de tiempo establecidos.
La Escala de Glasgow (Glasgow Coma Scale [GCS]) es hoy día esencial en la clasificación de los pacientes con un TCEG, pero ha ido perdiendo fiabilidad a la hora de evaluar la gravedad del trauma debido principalmente a la cada vez más frecuente utilización precoz de sedación, intubación y ventilación en pacientes con TCEG2. La TC aporta información esencial del diagnóstico de la lesión estructural producida tras una TCEG y la necesidad de realizar una intervención quirúrgica o monitorización de la PIC, por lo que ha ido adquiriendo una mayor relevancia en la clasificación y pronóstico de estos pacientes.
En 1991, Marshall et al.3 introdujeron una clasificación de la TC basada en la experiencia del Traumatic Coma Data Bank (TCDB), agrupando pacientes con TCEG de acuerdo con determinadas características de la TC. El fin de esta clasificación era descriptivo, y desde entonces se ha convertido en el estándar utilizado en la evaluación y en el pronóstico final de estos pacientes. Hoy día es la más utilizada en los estudios de TCEG, ya que describe adecuadamente la lesión estructural; sin embargo, presenta alguna dificultad de interpretación: no describe el tipo de lesión, no evalúa la hemorragia subaracnoidea (HSA) ni tampoco aporta un claro criterio en la indicación quirúrgica2,4-12. Además, esta clasificación no tiene una base fisiopatológica. Maas9 mostró que puede ser preferible utilizar los hallazgos individuales de la TC a la clasificación de Marshall con fines pronósticos o bien una combinación de ambos10.
Una de las complicaciones más importantes del TCEG es el desarrollo de un hematoma intracraneal, que aparece en una proporción importante de pacientes13,14. A pesar de esto, no existe una clara indicación del momento de la cirugía15, ni tampoco en el procedimiento a realizar para evacuar el hematoma. En los últimos años ha resurgido el interés por la craniectomía descompresiva (CD), si bien todavía no está considerado como el protocolo estándar16.
Aunque las indicaciones de la monitorización de la PIC están bien especificadas desde hace décadas y recomendadas en las Guías de la Brain Trauma Foundation (BTF)17,18, no hay suficientes trabajos prospectivos aleatorizados que demuestren una mejor evolución en los pacientes monitorizados que reciben un tratamiento estándar para controlar la elevación de la PIC, por lo que todavía existe una gran variabilidad en la indicación de la monitorización de la PIC, incluso dentro de un mismo hospital. Recientemente, un estudio aleatorizado no ha encontrado diferencias significativas en el resultado final entre pacientes monitorizados y no monitorizados19, lo que generó una gran controversia20. Otro estudio que compara 2 cohortes de pacientes tratados en diferentes hospitales21, uno con monitorización y otro sin ella, no demostró mejoría en la evolución final en los pacientes que sobrevivieron más de 24h. El estudio del European Brain Injury Consortium (EBIC)2,22 mostró que la frecuencia de la monitorización de la PIC en Europa era del 37% (5-53%), siendo esta frecuencia más elevada en Estados Unidos23.
ObjetivoDescribir la tendencia de las características de la TC, del tratamiento quirúrgico, de la frecuencia y adherencia a la guías de monitorización de la PIC en una cohorte representativa de pacientes con TCEG ingresados en un único centro en los últimos 25años, dividido en 3 periodos de tiempo (1987-1995, 1996-2004 y 2005-2012).
MétodosLos criterios de admisión y las características epidemiológicas y clínicas de esta población ya han sido publicados1. Resumiendo, la base de datos del Hospital 12 de Octubre contiene pacientes adultos (≥15años) admitidos en las primeras 48h del trauma, tras sufrir un TCEG cerrado (GCS≤8 tras resucitación no quirúrgica o deterioro a esta puntuación en 48h). Se excluyen los pacientes con gran inestabilidad hemodinámica, que impide el traslado al área radiológica y que fallecen precozmente, o bien los que ingresan intubados con una TC normal o con mínimas lesiones y que al retirar la sedación obedecen órdenes en las primeras horas.
Características radiológicas (daño estructural)Todos los pacientes tienen una TC inmediata realizada tras resucitación y estabilización. En raras ocasiones la TC inicial está realizada en el hospital de referencia. Los hallazgos se clasificaron de la siguiente forma:
- 1.
Clasificación de Marshall (Traumatic Coma Data Bank [TCDB])3: TC I (normal), TC II (difusa), TC III (swelling), TC IV (swelling con desplazamiento), TC V (masa evacuada) y TC VI (masa no evacuada).
- 2.
Tipo de lesión en la TC4,6,7,9,10:
- a.
Hemorragia subaracnoidea traumática (HSA). Se definió como la presencia de sangre en cualquier cantidad en el espacio subaracnoideo de la convexidad o de la base.
- b.
Hemorragia intraventricular (HIV). Cualquier cantidad de sangre intraventricular.
- c.
Cisternas basales. Se categorizaron en 2 grupos: normales y comprimidas o ausentes.
- d.
Desviación de la línea media en mm. También se categorizó en ≤5mm versus >5mm.
- e.
Presencia, tipo, multiplicidad y asociaciones de las lesiones masa. Hematoma epidural (HED), hematoma subdural (HSD) y hematoma intracerebral (HIC), agrupándose en este último las contusiones y los hematomas puros. El volumen individual de la lesión se calculó según la fórmula (A×B×C/2)24,25, y el volumen total se categorizó en 2 grupos: ≤25cc y >25cc.
- a.
Se realizó en todos los pacientes, excepto en los que fallecieron precozmente debido a la gravedad del trauma inicial (338 pacientes [18,5%]), por lo que quedan 1.492 pacientes con TC de control. Si los pacientes estaban respiratoria y hemodinámicamente estables, se realizaron controles entre las 6-48h del trauma dependiendo del tiempo de admisión, del tipo de lesión y del procedimiento quirúrgico realizado. Todos los pacientes intervenidos tuvieron una TC realizada inmediatamente tras la cirugía. Además, se practicó en cualquier momento ante una elevación de la PIC o un deterioro clínico. Para definir el cambio en la patología intracraneal, si la hubiera, definimos como el «peor TC» a aquel con el peor pronóstico según la clasificación de la TCDB, considerándose este como el «TC final» en los 10 primeros días8,26.
Tratamiento médicoEste estudio no está diseñado para valorar la eficacia del tratamiento médico en la evolución final o en la PIC, por lo que no incluimos variables terapéuticas en nuestro estudio. Como regla general, todos los pacientes ingresaron directamente en una UCI dedicada exclusivamente al tratamiento de los pacientes traumatizados y fueron tratados uniformemente de acuerdo con protocolos internacionales17,27, incluyendo ventilación, monitorización hemodinámica y PIC, con reducción de la PIC si esta supera los 20-25mmHg y mantenimiento de una presión de perfusión adecuada. Este tratamiento médico se mantuvo hasta normalización de los niveles de la PIC durante 24/48h y ausencia de efecto masa en la TC control.
Tratamiento quirúrgicoLa cirugía se realizó tras estabilización hemodinámica y con un adecuado estudio de coagulación. Se consideró cirugía precoz la realizada en las primeras 12h del trauma y tardía si fue intervenido posteriormente, aunque puede haber pacientes intervenidos en ambos periodos. Las indicaciones generales para la cirugía fueron similares a las recomendadas en las guías14,24: a)deterioro clínico; b)hematoma (>25-30cc) con desviación de la línea media >5mm y obliteración de las cisternas basales o iiiventrículo, y c)PIC elevada o no controlada médicamente.
Clasificamos el procedimiento quirúrgico realizado en 3 grupos: a)craneotomía con evacuación del hematoma; b)CD con retirada del hueso y evacuación del hematoma, con el fin de aumentar el volumen de la cavidad craneal, procedimiento que se realizó tanto para la evacuación primaria del hematoma (CD primaria) como para controlar una elevación de la PIC que no responde a tratamiento médico (CD secundaria), y c)otros procedimientos tales como trépanos, elevaciones de fragmentos hundidos, derivaciones de líquido cefalorraquídeo, etc. No fue considerado tratamiento quirúrgico si solo se colocó el sensor de la PIC.
Monitorización de la presión intracranealEn los primeros años (1987-1991) se realizó con un catéter intraventricular; tras la introducción de los transductores de presión intraparenquimatosos (Camino Laboratories, Integra, EE. UU.) la gran mayoría de los pacientes fueron monitorizados con este dispositivo. Se monitorizaron 1.049 (57,3%) pacientes; los no monitorizados (781 [42,7%]) fueron generalmente aquellos con una grave lesión en la TC inicial y una mala situación neurológica (midriasis bilateral o ausencia de respuesta motora tras resucitación) que fueron considerados «no-recuperables». Por otro lado, los pacientes con una TC inicial con una lesión difusa, sin efecto masa ni en ese primer TC ni en la TC de control, o en HED puros operados en los que no había desviación significativa de la línea media, tampoco fueron monitorizados.
El sensor de la PIC se colocó en el hemisferio más afectado, en las primeras 24h en todos los pacientes y siempre tras un estudio de coagulación adecuado. Para el análisis de la PIC, clasificamos a esta en 3 grupos: a)no monitorización de la PIC; b)baja/controlada (PIC normal <20mmHg o controlada con tratamiento médico o quirúrgico), y c)PIC elevada y no controlable a pesar de tratamiento médico o quirúrgico.
Adherencia a las Guías17Siguiendo las recomendaciones de las Guías BTF, la PIC se debe monitorizar a todos los pacientes «salvables» con un TCEG (GCS≤8 tras resucitación no quirúrgica en un periodo de 6h después del trauma) y con un TC anormal. Si la TC fuera normal, estaría indicado monitorizar la PIC si se cumplen 2 o más premisas: edad >40años, puntuación motora 2-3 uni o bilateral, o presión arterial sistólica ≤90mmHg. Definimos adherencia a las Guías cuando se han cumplido estos criterios.
No existe un criterio estándar para definir pacientes «salvables», por lo que utilizamos la puntuación obtenida en un estudio previo para pronosticar mortalidad precoz (48h)28. Se excluyeron los pacientes con más del 80% de probabilidad de morir en los primeros 2días, por lo que quedan 1.622 pacientes para este análisis.
Análisis estadísticoLas variables continuas se presentaron como media ±desviación estándar (DE) y las categóricas como frecuencias absolutas y relativas. La significación estadística de la comparación de proporciones fue determinada utilizando el test del chi-cuadrado o el de Fisher. El test de Cochran-Mantel-Haenszel se utilizó en las variables ordinales; por ejemplo, edad o periodos de tiempo. Las comparaciones de la distribución de los valores continuos (edad, momento TC, volumen) fueron realizadas utilizando el análisis de la varianza (ANOVA), con el valor de la p para test múltiples (Bonferroni).
Se realizó un estudio de regresión logística multivariable utilizando el método de eliminación hacia atrás con selección de p=0,05, para estimar la asociación entre los predictores (edad, periodo de tiempo, puntuación motora, deterioro clínico, estado cisternal, desviación línea media, HSA, HIV, tipo y volumen de la masa intracraneal) y las variables finales (cirugía, monitorización PIC y niveles PIC). Los resultados se muestran como OR con un intervalo de confianza (CI) del 95% y los valores de la p de los predictores.
Las variables independientes incluidas en el proceso de selección tuvieron correlaciones inferiores a 0,5. No se incluyeron interacciones en el proceso de selección. Para cuantificar la discriminación utilizamos el área bajo la curva (AUC)29.
Todos los datos se generaron utilizando SPSS, versión 16.0 (SPSS, Inc., Chicago, IL, EE.UU.).
ResultadosDatos radiológicosEn el 95% de los pacientes la TC se realizó en las primeras 7h y 45min. El tiempo entre el trauma y la realización del primer TC se redujo de 4,1h en el primer periodo, a 2,5h en el segundo y a 2,4h en el último (p<0,001), mostrando una diferencia significativa entre el primer periodo y los otros dos (p<0,001).
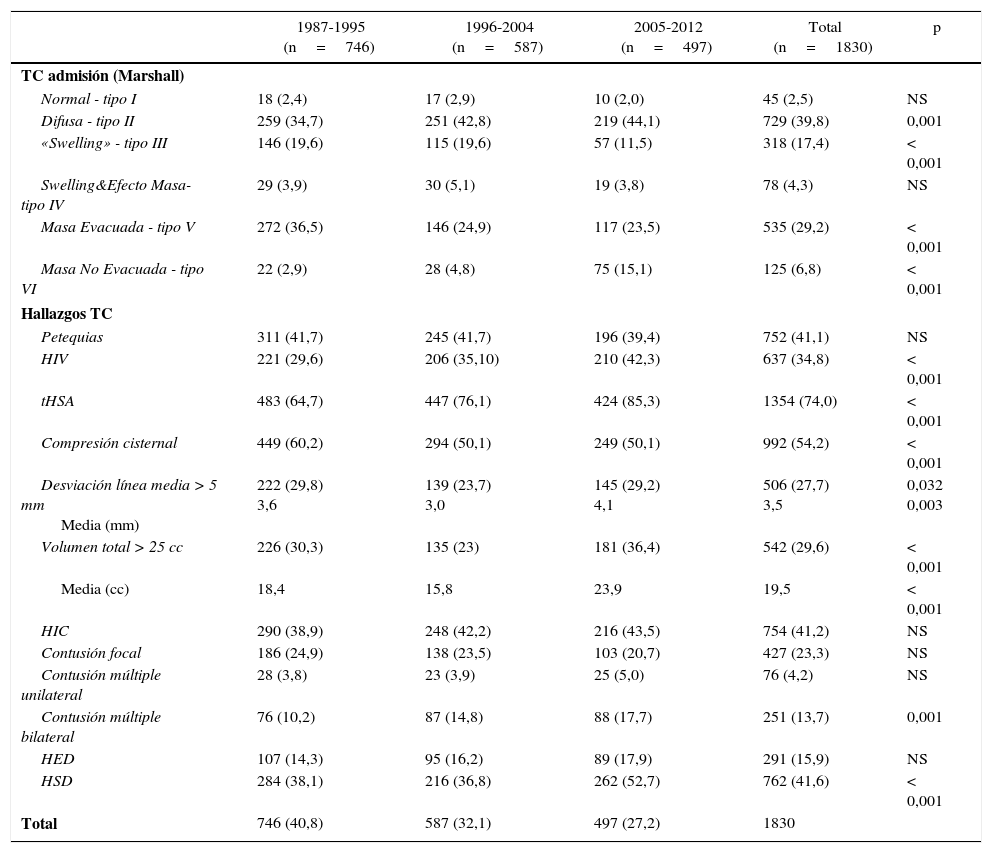
En la tabla 1 mostramos los hallazgos de la TC inicial (TCDB y tipo de lesión) en los 3 periodos. La TC fue normal (TCDB tipo i) solo en 45 pacientes (2,5%). Se apreció un aumento significativo de las lesiones de tipo difuso (TCDB tipo ii), p=0,001, y una significativa menor frecuencia en las lesiones con edema (TCDB tipo iii y iv, p<0,001). Las lesiones tipo masa mostraron una reducción significativa en las evacuadas (TCDB tipo v, p<0,001), pero con un aumento significativo en las no evacuadas (TCDB tipo vi, p<0,001).
Relación entre la clasificación de la TC inicial Marshall (TCDB) y tipo de lesión intracerebral con los 3 periodos de tiempo
| 1987-1995 (n=746) | 1996-2004 (n=587) | 2005-2012 (n=497) | Total (n=1830) | p | |
|---|---|---|---|---|---|
| TC admisión (Marshall) | |||||
| Normal - tipo I | 18 (2,4) | 17 (2,9) | 10 (2,0) | 45 (2,5) | NS |
| Difusa - tipo II | 259 (34,7) | 251 (42,8) | 219 (44,1) | 729 (39,8) | 0,001 |
| «Swelling» - tipo III | 146 (19,6) | 115 (19,6) | 57 (11,5) | 318 (17,4) | < 0,001 |
| Swelling&Efecto Masa- tipo IV | 29 (3,9) | 30 (5,1) | 19 (3,8) | 78 (4,3) | NS |
| Masa Evacuada - tipo V | 272 (36,5) | 146 (24,9) | 117 (23,5) | 535 (29,2) | < 0,001 |
| Masa No Evacuada - tipo VI | 22 (2,9) | 28 (4,8) | 75 (15,1) | 125 (6,8) | < 0,001 |
| Hallazgos TC | |||||
| Petequias | 311 (41,7) | 245 (41,7) | 196 (39,4) | 752 (41,1) | NS |
| HIV | 221 (29,6) | 206 (35,10) | 210 (42,3) | 637 (34,8) | < 0,001 |
| tHSA | 483 (64,7) | 447 (76,1) | 424 (85,3) | 1354 (74,0) | < 0,001 |
| Compresión cisternal | 449 (60,2) | 294 (50,1) | 249 (50,1) | 992 (54,2) | < 0,001 |
| Desviación línea media > 5 mm Media (mm) | 222 (29,8) 3,6 | 139 (23,7) 3,0 | 145 (29,2) 4,1 | 506 (27,7) 3,5 | 0,032 0,003 |
| Volumen total > 25 cc | 226 (30,3) | 135 (23) | 181 (36,4) | 542 (29,6) | < 0,001 |
| Media (cc) | 18,4 | 15,8 | 23,9 | 19,5 | < 0,001 |
| HIC | 290 (38,9) | 248 (42,2) | 216 (43,5) | 754 (41,2) | NS |
| Contusión focal | 186 (24,9) | 138 (23,5) | 103 (20,7) | 427 (23,3) | NS |
| Contusión múltiple unilateral | 28 (3,8) | 23 (3,9) | 25 (5,0) | 76 (4,2) | NS |
| Contusión múltiple bilateral | 76 (10,2) | 87 (14,8) | 88 (17,7) | 251 (13,7) | 0,001 |
| HED | 107 (14,3) | 95 (16,2) | 89 (17,9) | 291 (15,9) | NS |
| HSD | 284 (38,1) | 216 (36,8) | 262 (52,7) | 762 (41,6) | < 0,001 |
| Total | 746 (40,8) | 587 (32,1) | 497 (27,2) | 1830 | |
HED: hematoma epidural; HIC: hematoma intracerebral; HIV: hemorragia intraventricular; HSA: hemorragia subaracnoidea; HSD: hematoma subdural; NS: no significativo.
La frecuencia de la HSA y de la HIV, habituales en las lesiones de tipo ii, aumentaron significativamente (p<0,001), si bien la frecuencia de las petequias fue constante. La compresión cisternal disminuyó significativamente (p<0,001), aunque la desviación de la línea media (p=0,03) y el volumen de la lesión superior a 25cc aumentaron (p<0,001). La frecuencia del HED y contusiones focales permaneció estable, pero la frecuencia del HSD (p<0,001) y la de las contusiones múltiples bilaterales aumentaron (p=0,001).
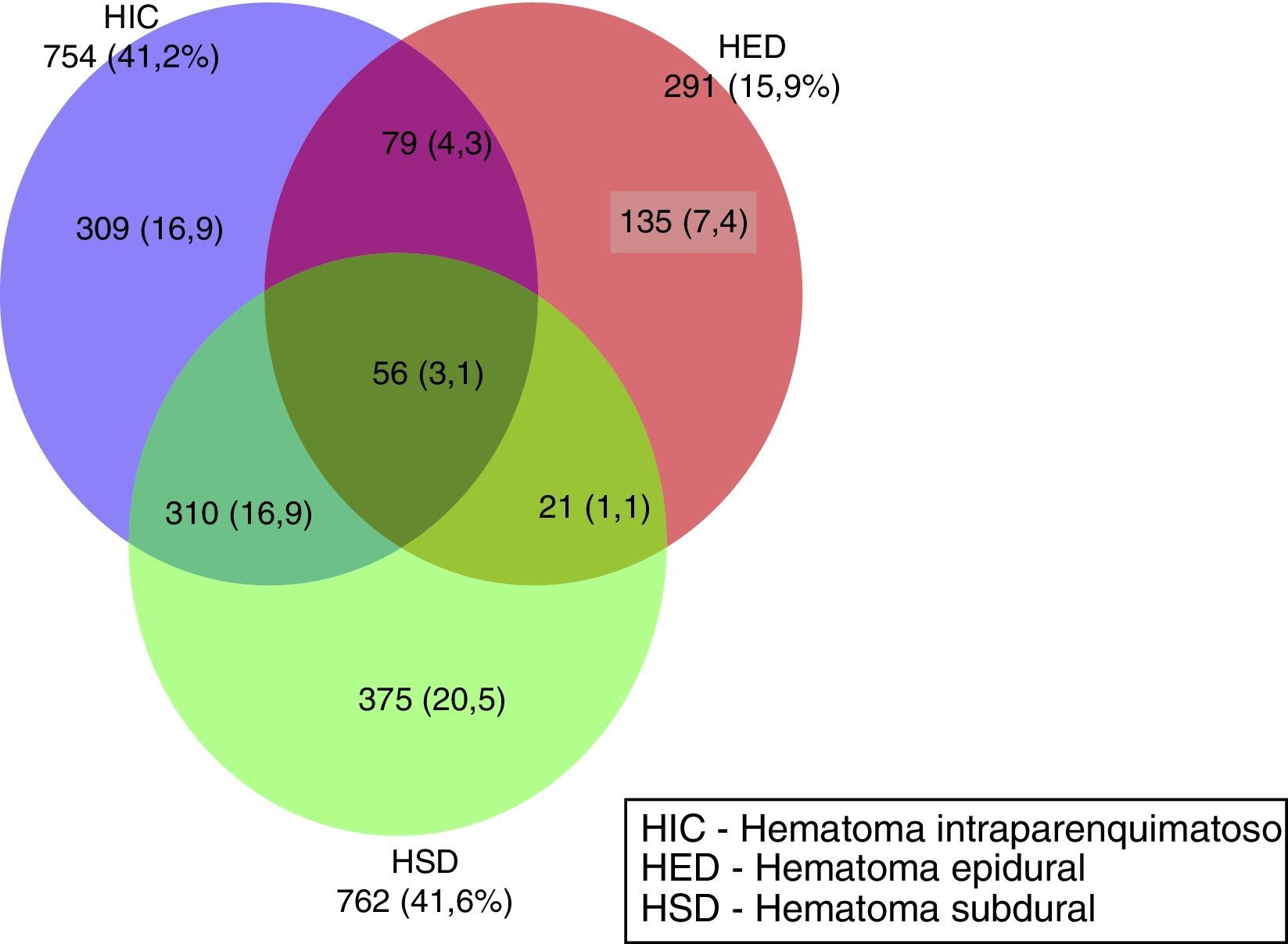
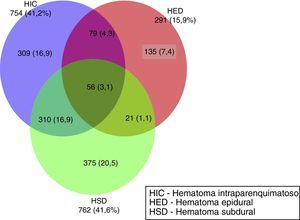
En la figura 1 se muestra la frecuencia de los hematomas intracraneales únicos y combinados que aparecen en la TC inicial. En 545 (29,8%) de los pacientes no existieron hematomas. El hematoma intracraneal único más frecuente fue el HSD, en 375 casos (20,5%), seguida por las contusiones (HIC) en 309 casos (17%) y, por último, los HED en 135 casos (7,4%). En 466 casos se apreció una combinación de lesiones; la más frecuente fue la asociación HSD con la HIC en 310 (16,9%) pacientes. Otras combinaciones fueron más infrecuentes.
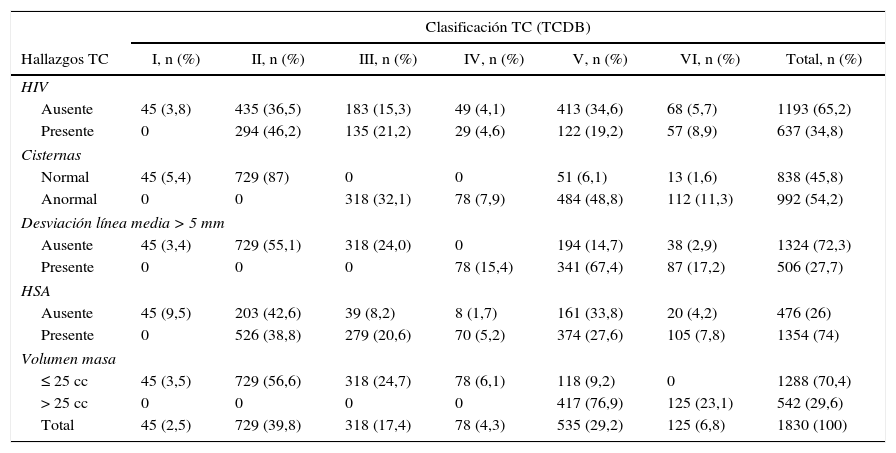
En la tabla 2 se muestran los hallazgos de la TC combinando la clasificación de Marshall y las características individuales de la TC. Entre los 535 pacientes con TCDB tipo v, 118 (22,1%) presentaron masas <25cc y 417 (77%) mayores. Se encontró una alta incidencia de HSA (74%), más frecuentemente asociada en pacientes con TCDB tipo iii (87,7%) o TCDB tipo iv (89,7%).
Asociación entre la TC inicial (TCDB) y hallazgos de la TC
| Clasificación TC (TCDB) | |||||||
|---|---|---|---|---|---|---|---|
| Hallazgos TC | I, n (%) | II, n (%) | III, n (%) | IV, n (%) | V, n (%) | VI, n (%) | Total, n (%) |
| HIV | |||||||
| Ausente | 45 (3,8) | 435 (36,5) | 183 (15,3) | 49 (4,1) | 413 (34,6) | 68 (5,7) | 1193 (65,2) |
| Presente | 0 | 294 (46,2) | 135 (21,2) | 29 (4,6) | 122 (19,2) | 57 (8,9) | 637 (34,8) |
| Cisternas | |||||||
| Normal | 45 (5,4) | 729 (87) | 0 | 0 | 51 (6,1) | 13 (1,6) | 838 (45,8) |
| Anormal | 0 | 0 | 318 (32,1) | 78 (7,9) | 484 (48,8) | 112 (11,3) | 992 (54,2) |
| Desviación línea media > 5 mm | |||||||
| Ausente | 45 (3,4) | 729 (55,1) | 318 (24,0) | 0 | 194 (14,7) | 38 (2,9) | 1324 (72,3) |
| Presente | 0 | 0 | 0 | 78 (15,4) | 341 (67,4) | 87 (17,2) | 506 (27,7) |
| HSA | |||||||
| Ausente | 45 (9,5) | 203 (42,6) | 39 (8,2) | 8 (1,7) | 161 (33,8) | 20 (4,2) | 476 (26) |
| Presente | 0 | 526 (38,8) | 279 (20,6) | 70 (5,2) | 374 (27,6) | 105 (7,8) | 1354 (74) |
| Volumen masa | |||||||
| ≤ 25 cc | 45 (3,5) | 729 (56,6) | 318 (24,7) | 78 (6,1) | 118 (9,2) | 0 | 1288 (70,4) |
| > 25 cc | 0 | 0 | 0 | 0 | 417 (76,9) | 125 (23,1) | 542 (29,6) |
| Total | 45 (2,5) | 729 (39,8) | 318 (17,4) | 78 (4,3) | 535 (29,2) | 125 (6,8) | 1830 (100) |
HIV: hemorragia intraventricular; HSA: hemorragia subaracnoidea.
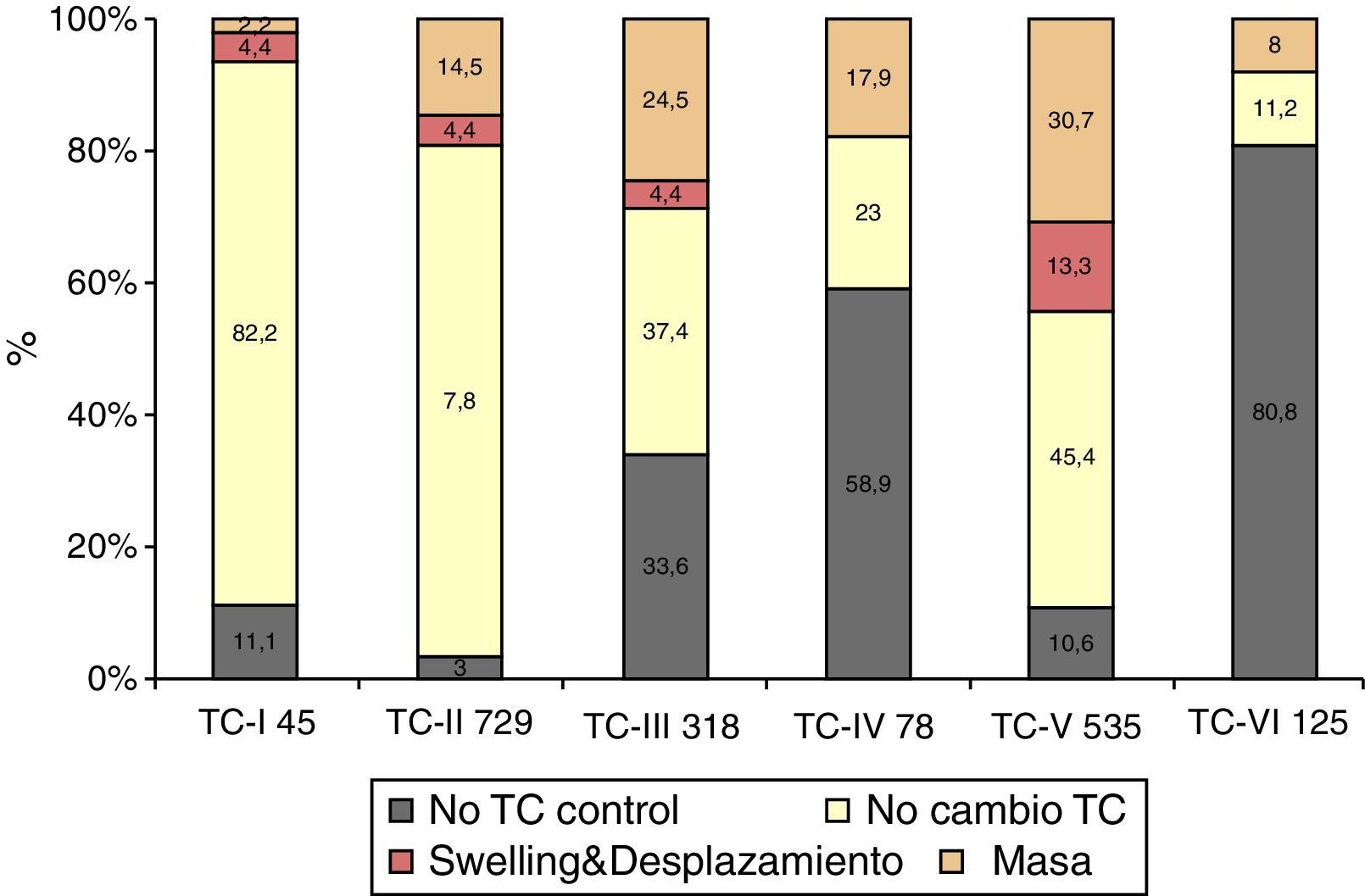
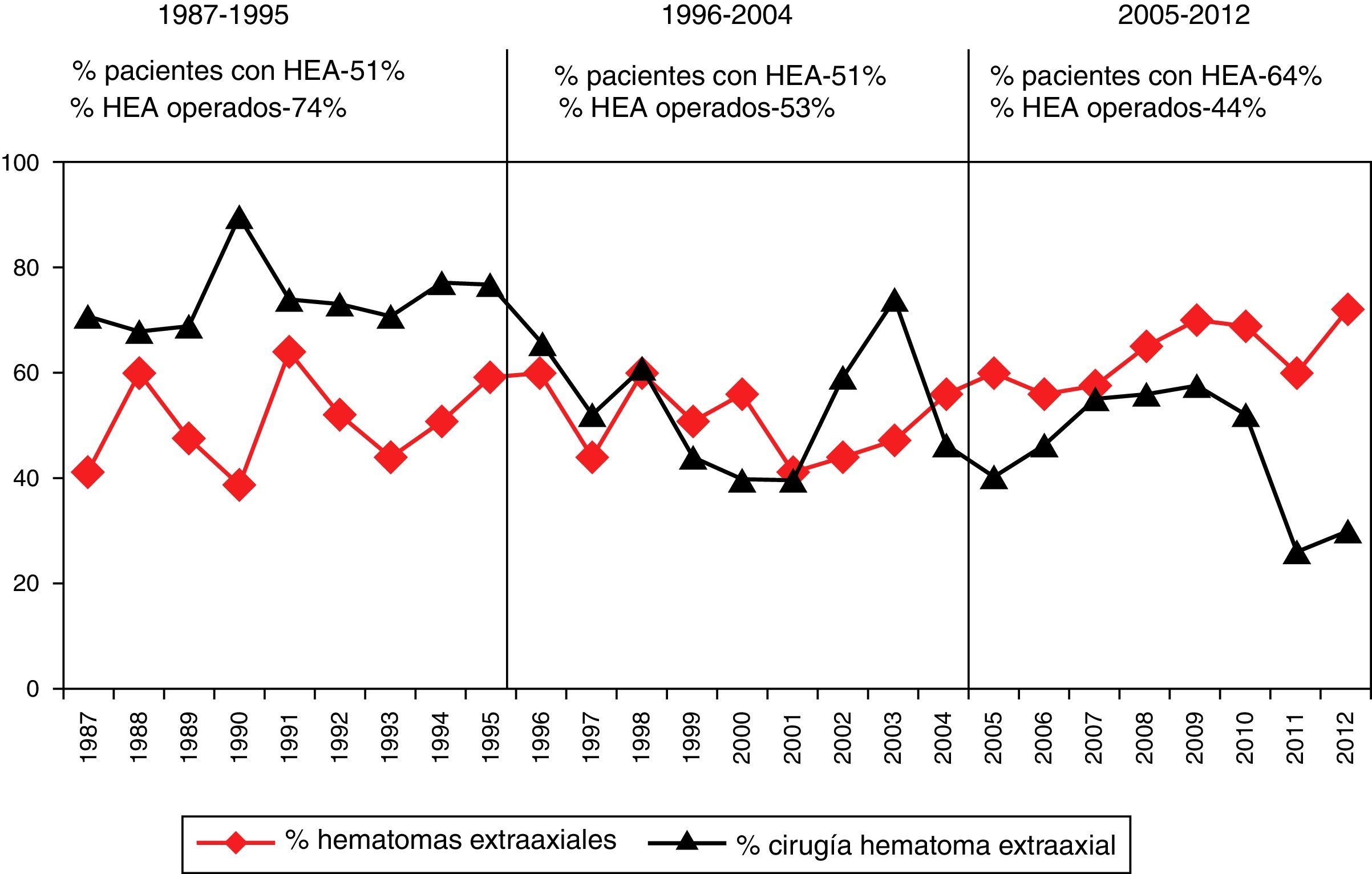
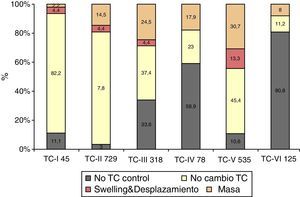
No se realizó TC de control en 338 (18,5%) pacientes. En los 1.492 pacientes restantes se realizó al menos una TC de control en las primeras horas del ingreso. Se apreció un empeoramiento en la clasificación de Marshall en 492 pacientes (33%). En el primer periodo de tiempo este cambio se apreció en el 37,4%, en el segundo en el 28,8% y en el tercero en el 30,9% (p=0,006). En la figura 2 se muestra cómo empeora la TC inicial. De los 45 pacientes con una TC inicial normal (tipo i), 2 (4,4%) desarrollarán swelling y uno (2,2%) una masa evacuada. De los 729 pacientes con TCDB tipo ii, 32 (4,4%) desarrollarán swelling y 106 (14,5%) una masa. De los 318 pacientes con TCDB tipo iii, en 14 (4,4%) aumentará el swelling con desplazamiento de línea media y 78 (24,5%) desarrollarán una masa. De los 78 pacientes con TCDB tipo iv, 14 (17,9%) desarrollarán una masa. De los 535 con una TCDB tipo v, 71 (13,3%) desarrollarán swelling y 164 (30,7%), una nueva masa. De los 125 pacientes con TCDB tipo vi, 10 (8%) fueron intervenidos por aumento de la masa. Por lo tanto, en total 119 (6,5%) pacientes desarrollaron swelling con o sin desplazamiento de la línea media y 373 (20,4%) una nueva/aumento de la masa intracraneal. De estos últimos, 260 (69,7%) fueron evacuadas y 113 (30,3%) no lo fueron.
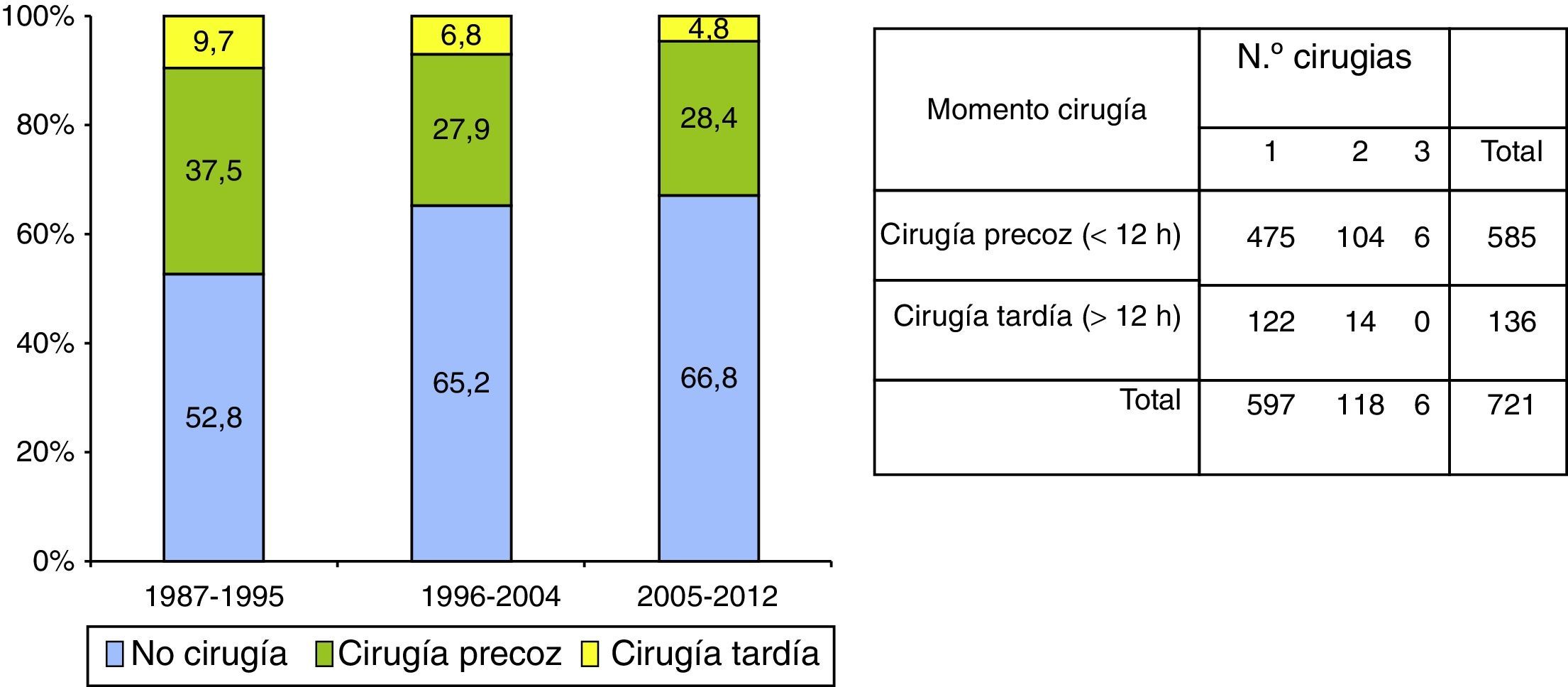
Tratamiento quirúrgicoLos detalles de tratamiento quirúrgico se muestran en la figura 3. En total se intervinieron 721 pacientes (34,8%): 352 (47,2%) entre 1987-1995, 204 (34,8%) entre 1996-2004 y 165 (33,2%) entre 2005-2012. En total, se realizaron 851 intervenciones quirúrgicas: 597 (82,8%) pacientes fueron operados una vez, 118 (16,4%) 2 veces y 6 (0,8%) 3 veces. La frecuencia de la intervención quirúrgica disminuyó significativamente, tanto en la cirugía temprana como en la tardía, con respecto al primer periodo de tiempo (1987-1995). La cirugía precoz (en las primeras 12h) se realizó en 585 (81,1%) pacientes: 280 (37,5%) en el primer periodo de tiempo, 164 (27,9%) en el segundo y 141 (28,4%) en el último. La cirugía se realizó más precozmente en el último periodo de tiempo (4,4, 4,2 y 3,5h, p=0,003). En 136 pacientes (18,9%) la cirugía se realizó pasadas las 12h (cirugía tardía), en 72 (9,7%) en el primer periodo, en 40 (6,8%) en el segundo y solo en 24 (4,8%) en el tercero.
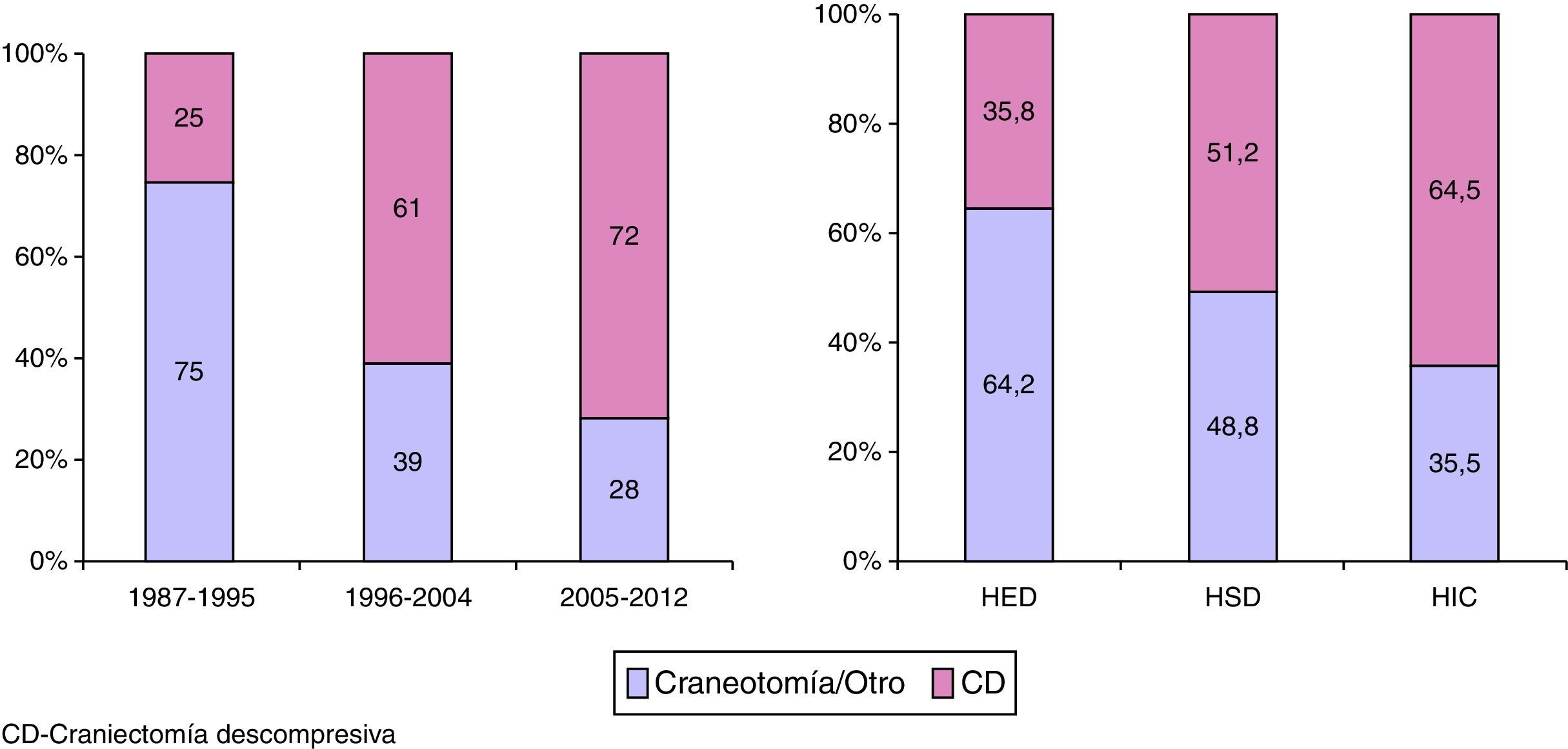
En la figura 4 se muestra la variación que ha habido en el procedimiento quirúrgico realizado. La CD se realizó en 88 pacientes (25,0%) en el primer periodo, en 124 (61%) en el segundo y en 119 (72%) en el tercero (p<0,001). En total la CD se realizó como primer o segundo procedimiento en 331 pacientes (45,9%): 266 (36,9%) dentro de las primeras 12h y en 65 (9,0%) pasadas 12h. En 36 (10,9%) pacientes se realizaron 2 CD. De los 721 pacientes operados, 218 lo fueron por un HED, 259 por un HIC y 418 por un HSD (más de una lesión pudo haber sido evacuada en la cirugía o, en caso de reacumulación de la lesión, la misma lesión pudo ser evacuada en más de una ocasión). La cirugía precoz se realizó en 195 (89,4%) pacientes con HED, en 366 (87,5%) con HSD y en 182 (70,3%) con contusiones. Se practicó una CD en 78 (35,8%) de los pacientes con HED, en 214 (51,2%) pacientes con un HSD y en 167 (64,5%) con contusiones.
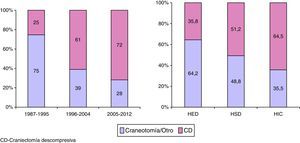
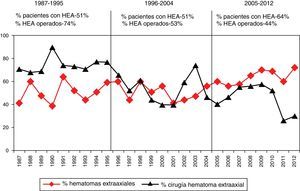
Entre los años 1987 y 2012 se apreció una disminución progresiva de los pacientes intervenidos por una lesión extracerebral (HED y HSD). Esta tendencia se muestra en la figura 5.
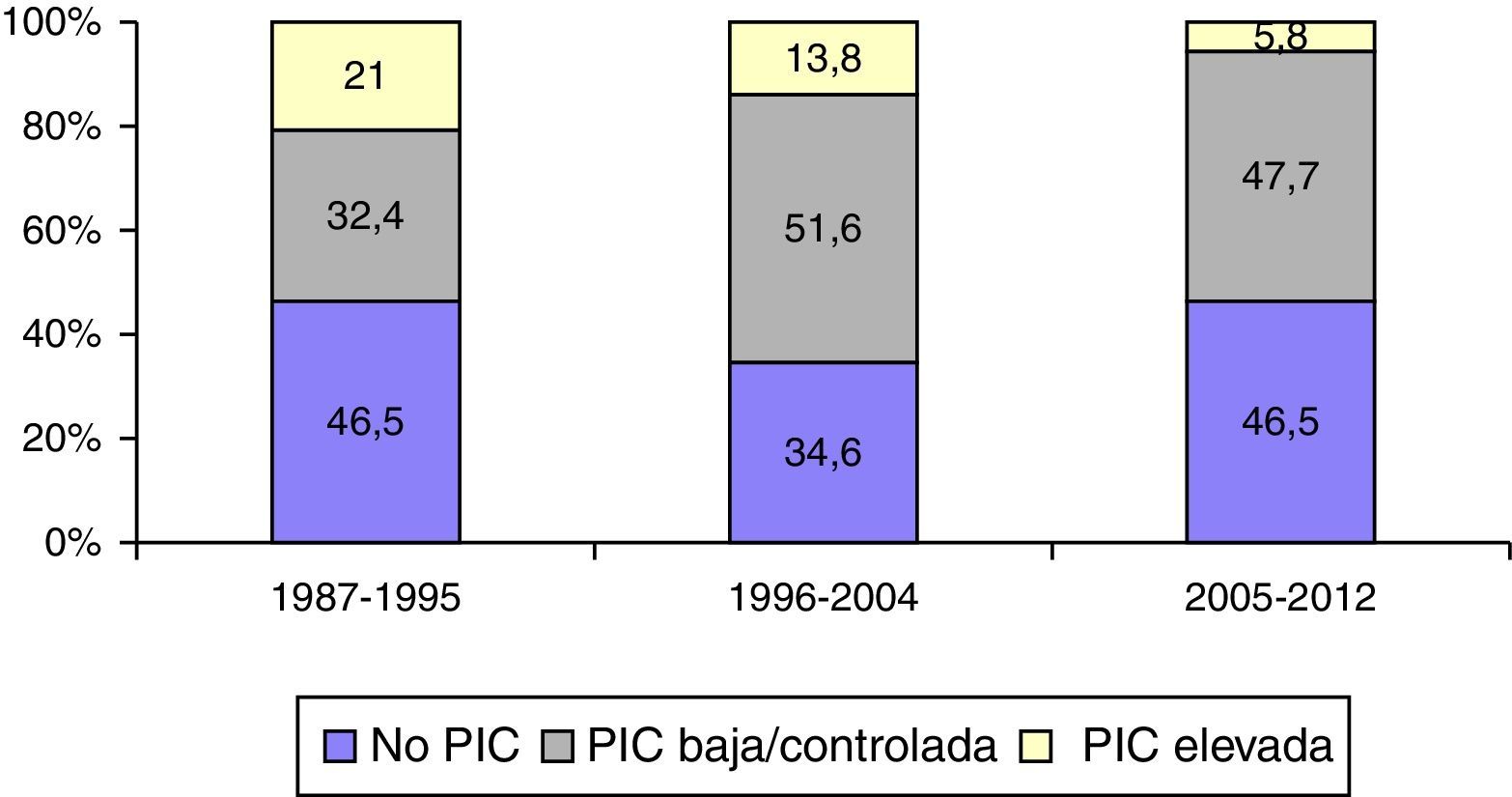
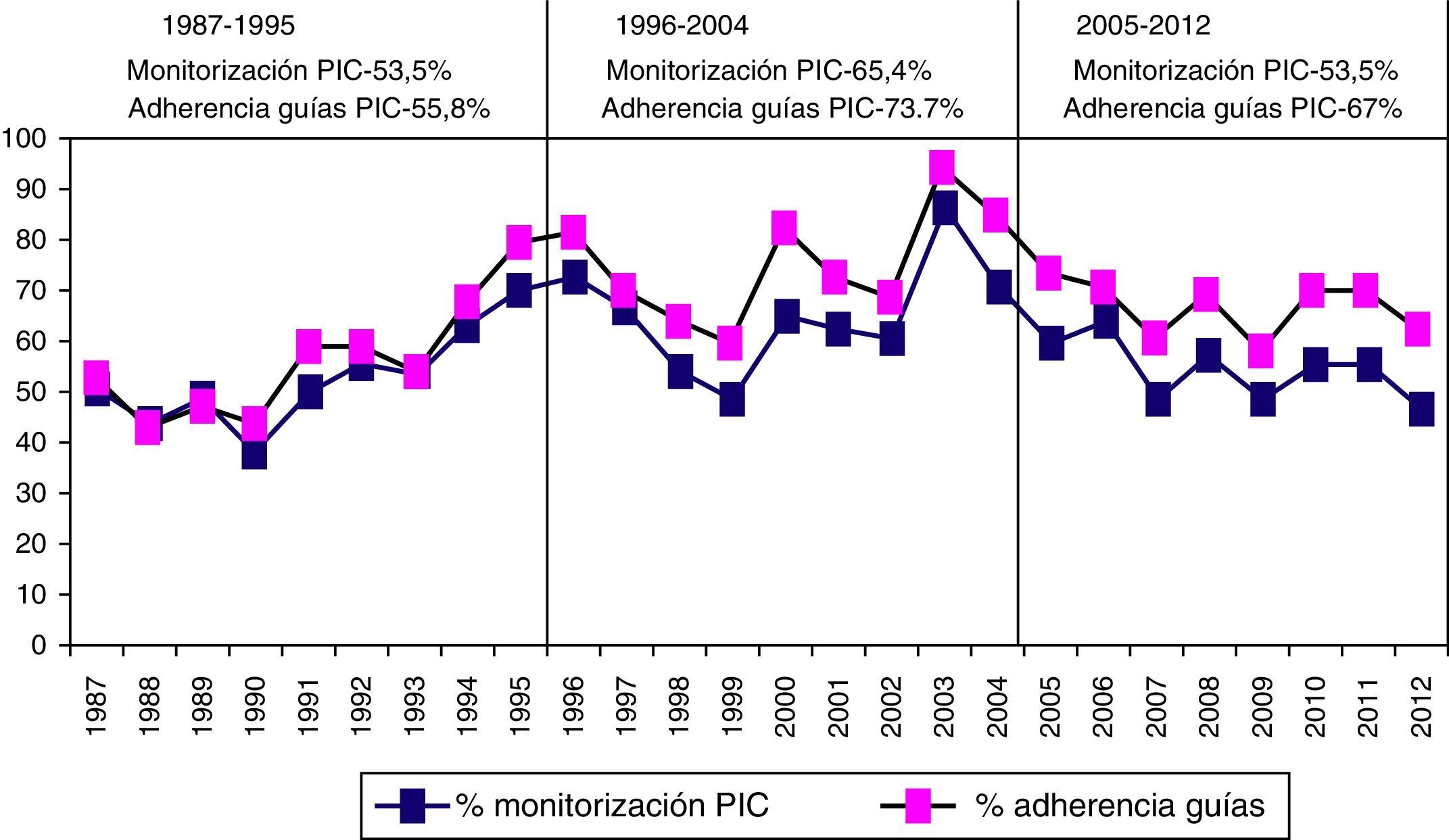
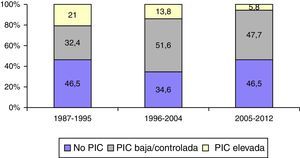
Monitorización de la presión intracranealEn la figura 6 se muestra la frecuencia de monitorización de la PIC y su respuesta al tratamiento en los 3 periodos de tiempo. Se monitorizaron 1.049 (57,3%) pacientes. En el primer periodo de tiempo, 399 (53,5%) fueron monitorizados vs. 347 (46,5%) que no lo fueron; en el segundo periodo, 384 (65,4%) vs. 203 (34,6%), y en el tercer periodo, 266 (53,5%) vs. 231 (46,5%). Fueron monitorizados significativamente más pacientes en el segundo periodo de tiempo (p<0,001). La proporción de pacientes con PIC elevada/incontrolable fue de 157 pacientes (21%) en el primer periodo versus 81 (13,3%) en el segundo y 29 (5,8%) en el tercero.
Las principales razones para no monitorizar a 781 (42,7%) pacientes fueron: a)edad: los pacientes no monitorizados tuvieron una edad más avanzada (p<0,001); solo 25/156 (16%) pacientes mayores de 70años fueron monitorizados; b)pacientes considerados no-salvables (muerte en 48h): de los 781 pacientes no monitorizados, 284 (32,5%) murieron en los primeros 2días, y c)lesiones difusas sin efecto masa en la TC inicial sin cambios en el control; únicamente se monitorizaron 53,2% de los pacientes con TCDB i o ii.
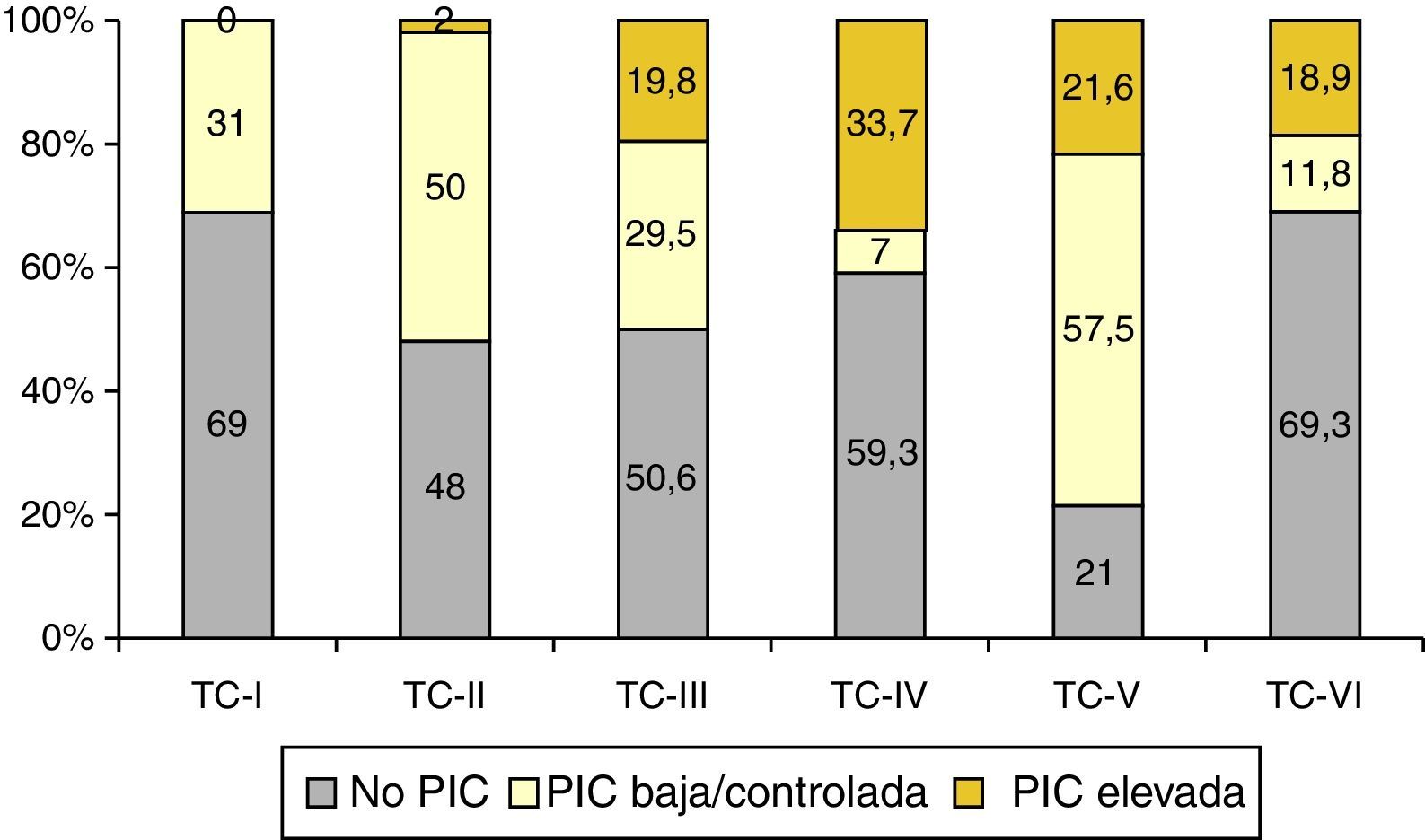
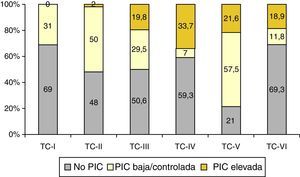
De los 1.035 pacientes con TC anormal monitorizados, 557 (54%) tuvieron elevaciones de la PIC. En la figura 7 se muestra la relación entre la TC final y la respuesta a la PIC y, como se puede apreciar, la mayor incidencia de pacientes no monitorizados pertenecen a las categorías i, iv y vi, siendo la TCDB tipo iv la más asociada a PIC elevada/no controlada.
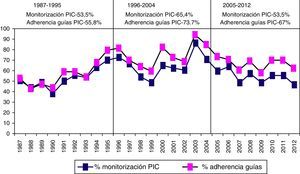
En la figura 8 se muestra la frecuencia de monitorización por año y la adherencia a las Guías BTF. Si excluimos los casos «no-salvables», que presentan una probabilidad de fallecimiento precoz en 48h>80% (1.622 pacientes), la adherencia a las Guías de la BTF fue del 63,4%.
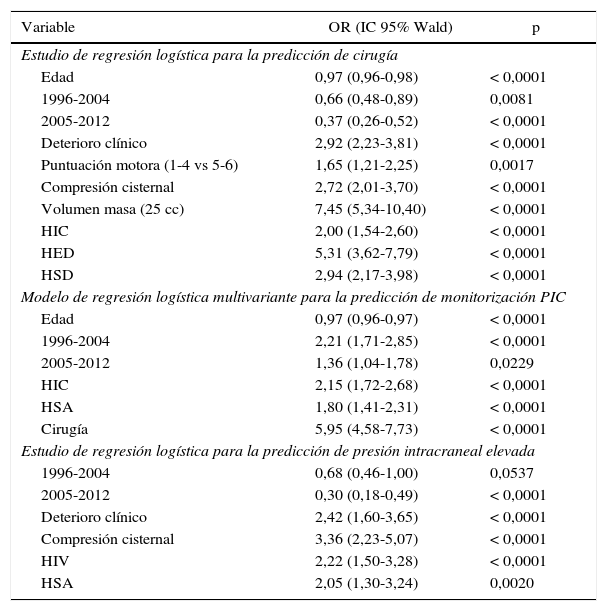
Estudio multivarianteEn la tabla 3 y en la figura 9 se muestran los resultados de estos estudios.
Estudio multivariante
| Variable | OR (IC 95% Wald) | p |
|---|---|---|
| Estudio de regresión logística para la predicción de cirugía | ||
| Edad | 0,97 (0,96-0,98) | < 0,0001 |
| 1996-2004 | 0,66 (0,48-0,89) | 0,0081 |
| 2005-2012 | 0,37 (0,26-0,52) | < 0,0001 |
| Deterioro clínico | 2,92 (2,23-3,81) | < 0,0001 |
| Puntuación motora (1-4 vs 5-6) | 1,65 (1,21-2,25) | 0,0017 |
| Compresión cisternal | 2,72 (2,01-3,70) | < 0,0001 |
| Volumen masa (25 cc) | 7,45 (5,34-10,40) | < 0,0001 |
| HIC | 2,00 (1,54-2,60) | < 0,0001 |
| HED | 5,31 (3,62-7,79) | < 0,0001 |
| HSD | 2,94 (2,17-3,98) | < 0,0001 |
| Modelo de regresión logística multivariante para la predicción de monitorización PIC | ||
| Edad | 0,97 (0,96-0,97) | < 0,0001 |
| 1996-2004 | 2,21 (1,71-2,85) | < 0,0001 |
| 2005-2012 | 1,36 (1,04-1,78) | 0,0229 |
| HIC | 2,15 (1,72-2,68) | < 0,0001 |
| HSA | 1,80 (1,41-2,31) | < 0,0001 |
| Cirugía | 5,95 (4,58-7,73) | < 0,0001 |
| Estudio de regresión logística para la predicción de presión intracraneal elevada | ||
| 1996-2004 | 0,68 (0,46-1,00) | 0,0537 |
| 2005-2012 | 0,30 (0,18-0,49) | < 0,0001 |
| Deterioro clínico | 2,42 (1,60-3,65) | < 0,0001 |
| Compresión cisternal | 3,36 (2,23-5,07) | < 0,0001 |
| HIV | 2,22 (1,50-3,28) | < 0,0001 |
| HSA | 2,05 (1,30-3,24) | 0,0020 |
HED: hematoma epidural; HIC: hematoma intracerebral; HIV: hemorragia intraventricular; HSA: hemorragia subaracnoidea; HSD: hematoma subdural; IC: intervalo de confianza; OR: odds ratio.
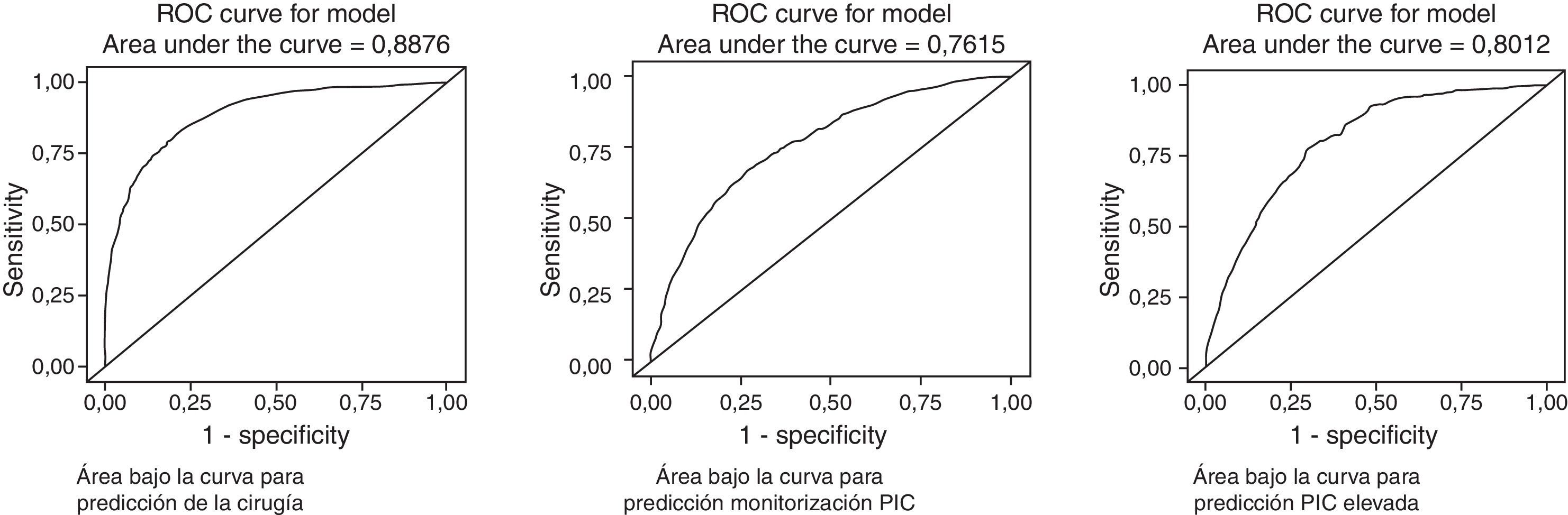
Las variables incluidas son las utilizadas habitualmente en las Guías24, siendo todas relevantes a la hora de decidir la necesidad de una intervención quirúrgica. La edad y el número de pacientes operados tienen una relación inversa con la cirugía; es decir, los pacientes con más edad se operan menos frecuentemente, y la frecuencia de la cirugía ha disminuido significativamente con respecto al primer periodo de tiempo (1987-1995). El factor pronóstico más importante relacionado con la cirugía es el volumen de la lesión >25cc. Otros factores predictivos independientes asociados con la cirugía son el deterioro clínico, una puntuación motora baja, la compresión cisternal y la presencia de cualquier tipo de hematoma intracraneal (HED, HSD e HIC). El AUC del modelo fue de 0,8876.
Monitorización de la presión intracranealLos factores predictores asociados con la colocación de un sensor para medir la PIC (monitorización vs. no monitorización como variable final) son: a)existe una diferencia significativa en la monitorización de pacientes ingresados en el segundo y tercer periodos de tiempo con respecto al primer periodo (1987-1996); b)la cirugía estaba fuertemente asociada a la monitorización; c)otros factores relacionados fueron la presencia de HSA y de HIC. La edad es un predictor inverso (los pacientes de más edad se monitorizan menos). El AUC del modelo fue de 0,7615.
Presión intracraneal elevada/incontrolableLos factores predictores asociados independientemente con la presencia de niveles elevados de PIC fueron: a)periodos de tiempo: en el primer periodo de tiempo (1987-1995) hubo una significativa mayor incidencia de PIC elevada; b)deterioro clínico; c)compresión cisternal, y d)presencia de HSA y HIV. El AUC de este modelo fue de 0,8012.
DiscusiónComo ya apreciamos en trabajos previos1,30, se ha producido un cambio en las características epidemiológicas y clínicas de la población de pacientes con TCEG. Esta tendencia también ha sido observada en otros países occidentales31,32; este nuevo escenario se debe a la reducción de los TCEG producidos tras accidentes de tráfico. No obstante, la incidencia de TCEG no relacionados con accidentes de tráfico (caídas) en pacientes de edad ha aumentado dramáticamente. En este nuevo estudio, continuación del anterior, encontramos un perfil diferente de paciente con TCEG, con distintos patrones de lesión estructural, evidenciado en los cambios significativos de hallazgos en la TC, en el procedimiento quirúrgico y en la monitorización de la PIC a lo largo del periodo de tiempo del estudio, determinando un cambio en el manejo de estos pacientes en estos años.
Características de la tomografía computarizada inicialLa clasificación de Marshall es un instrumento válido con fines descriptivos y pronósticos y es la utilizada rutinariamente para estratificar a pacientes de acuerdo a criterios morfológicos, presentando una alta concordancia entre observadores12. Además, su relevancia ha aumentado a lo largo de los años debido a la progresiva dificultad en la valoración de la escala de Glasgow, por la política de intubación y sedación precoz que se practica con mayor frecuencia en el TCEG hoy día. Si bien esta clasificación es la más utilizada en la actualidad, también presenta inconvenientes, tales como no tener en cuenta la presencia de HSA o HIV. Añadiendo estos hallazgos a la clasificación de Marshall se incrementa el poder predictivo del TCEG, mejorando la estratificación de los pacientes en los estudios aleatorizados9-12. Maas9,10 observó discordancias del 30-35% en la clasificación de la TC de estos pacientes, debido a una variabilidad interobservadores en la codificación de estos casos, por lo que recomienda utilizar esta clasificación conjuntamente con los hallazgos individuales con el fin de mejorar la fiabilidad pronóstica.
La TC normal o difusa (TCDB I y II) representa el 42,3% de nuestro estudio, oscilando esta frecuencia en otros estudios entre el 25 y el 55%33-36, reflejando los diferentes criterios de inclusión de los estudios del IMPACT10,37 y del CRASH38. Nuestro trabajo pone de manifiesto un aumento de la tendencia temporal en las lesiones tipo ii (34,7% a 44,1%), aumentando también significativamente la presencia de HSA y HIV.
La lesión tipo iii y iv en nuestro estudio representa el 21,7% de los pacientes, encontrándose una variabilidad en diferentes estudios entre el 11 y el 25%2,3,33-38. Se apreció un descenso de la TCDB tipo iii y iv de un 23,5% durante los años 1987-1995 a un 15,3% en el último periodo.
Las lesiones masa, operadas o no (tipo v y vi), representan el 36% de los pacientes en nuestro estudio. Esta proporción varía entre el 30 y el 48%2,3,33,36-38, o entre el 55 y el 63% en los estudios realizados en el Reino Unido34,35. Esta cifra depende de las diferentes indicaciones quirúrgicas y del tipo de lesión-masa. En nuestro estudio la frecuencia de masa no evacuada es del 6,8%, variando esta cifra en otros estudios2,3,33-36 entre el 5 y el 27%. La frecuencia de las lesiones-masa tuvo una distribución uniforme entre los 3 periodos de tiempo; sin embargo, esta frecuencia está compensada al haber un aumento significativo en la incidencia de las masas no operadas (TC tipo vi). Estas diferencias están en relación con el cambio epidemiológico descrito en nuestros pacientes. Pese a la carencia de estudios como el nuestro que describan el cambio temporal de la categoría del TC, sí es cierto que en estudios más antiguos se describe una frecuencia de lesiones evacuadas mayor3,34 que en los más recientes33. Tampoco se han publicado muchos estudios que tengan en cuenta la asociación de las lesiones-masa intracraneales39. Nosotros encontramos una incidencia del 16% de HED (único y combinado), dentro del rango de otros estudios, que se sitúan entre el 9%3 y el 21%39 La incidencia de HSD fue de 41,6%, similar a la del estudio austriaco39 o la serie de Bullock24 (49%), pero claramente superior a la del TCDB (29%)3. La incidencia del HIC (aislado o combinado) fue del 41,2%, oscilando en otros estudios entre el 35%24 y el 69%39. La combinación más frecuente fue HSD y contusión, que se apreció en el 16%, y las menos frecuentes fueron la asociación HED+HDS+HIC (3,1%) y HED+HSD (1%), ambas similares a la del estudio austriaco39.
La asociación entre HSA y edad avanzada en autopsias de pacientes con TCEG es un hallazgo bien conocido. En nuestro estudio encontramos un 74% de incidencia de HSA, significativamente mayor que la encontrada en otros estudios, especialmente asociada a lesiones con TCDB III y IV (87,7 y 89,7%, respectivamente). El análisis del IMPACT, realizado por Maas9,10, encontró una variación de la HSA entre el 28 y el 79%, con una media del 46% y una mayor asociación de la HSA en pacientes con TCDB tipo iii (58%) o tipo iv (71%), que en TCDB tipo ii (44%) o TCDB tipo v/vi (49%). En los estudios más modernos del Selfotel y del Bradykor la incidencia de HSA fue similar a la de nuestro estudio. En el EBIC2 esta incidencia varió entre el 33 y el 57%, y en otros estudios más recientes, entre el 43%33 y el 56%39. Las variaciones en la frecuencia de HSA entre las series publicadas probablemente refleje la variabilidad de las poblaciones incluidas en los estudios: pacientes con traumatismos menos graves tendrían una menor incidencia de HSA. En nuestro estudio observamos una tendencia a aumentar la frecuencia de HSA con el tiempo; además, en otro estudio (Gómez: datos no publicados) encontramos una clara asociación de la HSA con la edad avanzada y la TCDB tipo iii y iv, lo que podría estar en relación con una mayor fragilidad de las arterias de pacientes añosos. Servadei11 evidenció que la presencia de HSA estaba relacionada con una edad avanzada y una pobre respuesta motora.
Tomografía computarizada de controlEl TCEG es un proceso dinámico en el que las lesiones pueden evolucionar, por lo que la TC de control es esencial. Lobato8 encontró alrededor de un 50% de variación en la clasificación de la TC inicial en pacientes con TCEG (GCS≤8), siendo mejor predictor de la evolución final la TC de control. Servadei40 publicó una progresión radiológica en la clasificación de Marshall en el 16% de los pacientes con TCEG moderado (GCS 3-12). Estudios recientes evidencian que la progresión de la lesión generalmente sucede entre las 6-9h del trauma y es mayor si la TC inicial se realiza en las primeras 2h. Las HIC pueden crecer en el 25-45% de los casos41-44, por lo que la TC de control está siempre indicada si hay un deterioro clínico o un aumento de la PIC8,45.
La reducción en la incidencia de deterioro de la TC inicial en los últimos 2 periodos de tiempo, respecto a la apreciada en 1987-1995, unido a la disminución del deterioro clínico y de la hipoxia que vimos en el primer trabajo1, podría reflejar la mejora de los cuidados prehospitalarios de estos pacientes, con un traslado más rápido al hospital y una mejor monitorización respecto al primer periodo de tiempo.
Tratamiento quirúrgicoEn total se intervinieron 721 pacientes (39,4%), la mayoría (585) en las primeras 12h, una cifra similar a la del EBIC2, aunque existe una gran variabilidad en series publicadas (23-69%14,33,34,39). Las razones de estas diferencias no están claras, pero pueden ser debidas a un diferente case-mix. El tipo de hematoma es un factor importante a la hora de hacer un pronóstico, por lo que es un aspecto que debe ser considerado al describir estos pacientes con TCEG.
El tratamiento de los hematomas tras un TCEG todavía no está del todo resuelto. La técnica utilizada y el momento apropiado de la cirugía son motivo de controversia. Las guías quirúrgicas publicadas carecen de una base científica robusta24. Nuestras indicaciones quirúrgicas son similares a estas, encontrando en nuestro estudio multivariante que el volumen mayor de 25cc es el factor independiente más fuertemente asociado al tratamiento quirúrgico, similar a lo publicado por otros autores24,46.
La indicación quirúrgica del HED y del HSD con un tamaño significativo no ofrece dudas, todos los autores están de acuerdo que deben ser intervenidos lo antes posible para evitar herniaciones cerebrales24. En nuestro trabajo se realizó una intervención precoz de estas lesiones en el 89,4 y el 87,5%, respectivamente; sin embargo, la evacuación del HIC presenta una mayor variabilidad. La razón principal para realizar una intervención precoz en estos casos es evitar el desarrollo de las lesiones cerebrales secundarias14,24. Mendelow (STITCH [Trauma])15 en un estudio prospectivo aleatorizado encuentra una mejor evolución en los casos operados antes de que ocurra un deterioro, que en aquellos pacientes operados después de que este suceda. El STITCH tuvo que pararse por una falta de medios, siendo necesario un ensayo más grande para confirmar esta tendencia hacia la cirugía precoz. En nuestro estudio la cirugía precoz de HIC bajó al 70,3%, lo que refleja esta discrepancia.
No siempre hay que evacuar un hematoma; se encuentran casos seleccionados con un volumen pequeño o moderado y discreto efecto masa en los que se puede seguir la evolución con una adecuada vigilancia clínica mediante TC de control seriados y monitorización de la PIC hasta la reabsorción de la lesión. En nuestros casos se intervinieron 418 (54,8%) del total de 762 HSD, aunque este porcentaje está reducido por incluir casos no operados de pacientes con edad avanzada y pacientes no salvables con una mala situación clínica. Un hallazgo relevante en nuestro estudio es la constatación de una reducción del tratamiento quirúrgico de las lesiones extraaxiales (HED y HSD) entre 1996 y 2012, con respecto al primer periodo de tiempo (1987-1995), superponible a un reciente estudio estadounidense47. Las razones para este hallazgo son difíciles de explicar, pero podría ser debido a un cambio en la práctica clínica (menos cirugía en pacientes con subdural y edad avanzada), como se podría deducir por el aumento de TC tipo vi en el último periodo o bien a un diferente case-mix. La frecuencia del HED ha permanecido estable en los 3 periodos, pero la frecuencia del HSD ha aumentado del 38,1 al 52,7% en el último periodo.
El tratamiento estándar para la evacuación las lesiones ocupantes de espacio con efecto masa es la craneotomía, con el fin de disminuir la presión sobre el cerebro24. La CD primaria puede ser realizada con los mismos fines o bien posteriormente para disminuir la hipertensión intracraneal refractaria a tratamiento médico (CD secundaria). El estudio DECRA48 no demostró una mejoría de la evolución final de los pacientes a los que se realizó una CD secundaria; tampoco un estudio sistemático de la Cochrane16 encontró evidencia para recomendar el uso rutinario de la CD en estos pacientes. Un estudio ha mostrado un aumento de neurocirujanos que utilizan esta técnica; sin embargo, no se han establecido con firmeza los criterios quirúrgicos49,50. En general, la literatura sugiere, pero no prueba, que la CD es la intervención de elección. En nuestra práctica se muestra una tendencia a la realización de este procedimiento sobre todo tras la evacuación de un HIC, siendo el procedimiento más utilizado en la actualidad. En el momento actual hay un estudio pendiente de completar para tratar de evaluar la eficacia de este tratamiento RESCUEicp (www.rescueicp.com).
Monitorización de la presión intracranealMarshall51,52 y Miller18 fueron de los primeros en demostrar la relación entre la PIC y la evolución final de los pacientes con TCEG. La monitorización de este parámetro se demostró que era de gran ayuda a la hora de detectar un daño secundario incipiente o el desarrollo de un hematoma45,53, relacionando altos niveles de PIC con la mortalidad. En los años ochenta muchos autores preconizaron el uso de terapias dirigidas a la PIC, comparando la mortalidad obtenida en sus casos con un tratamiento sistemático de la PIC (28-36%)18,52 con la mortalidad observada en un estudio previo de Jennett et al.34 (50%). Las Guías de la BTF se publicaron en 1996, recomendando que la PIC se debería utilizar para monitorizar todos los pacientes «salvables» con un TCEG (GCS 3-8 tras resucitación) y una TC anormal17. En estos pacientes la probabilidad de tener elevaciones de la PIC era de alrededor del 50%, una cifra similar a la reportada en este estudio.
Aunque la monitorización y el tratamiento intensivo de la PIC se han convertido en un estándar hoy día, no existe una evidencia robusta que demuestre una mejoría en la evolución final. El único estudio aleatorizado prospectivo realizado hasta la fecha no ha encontrado beneficio en la monitorización de los pacientes sobre un protocolo basado en la clínica y los hallazgos de la TC. La evidencia del uso de la monitorización de la PIC no fue concluyente19; sin embargo, estos resultados fueron matizados en una reunión de expertos, recomendando continuar con la política de monitorización de la PIC20. Otros estudios europeos y una reciente revisión sistemática21,54 tampoco han encontrado beneficio en el uso de la monitorización. Un estudio realizado en el Reino Unido evidencia la gran variabilidad que todavía existe en el uso de esta técnica, lo que demuestra una falta de consenso en el manejo de estos pacientes55.
En nuestro trabajo, la PIC se monitorizó en el 57% de los pacientes, siendo más frecuentemente utilizada en el segundo periodo de tiempo quizá por la coincidencia en la participación de nuestro servicio en varios ensayos clínicos internacionales. El concepto «salvable» es un término difuso utilizado de diferente forma por los autores. En nuestro caso, se definió como aquellos pacientes que tenían una probabilidad de muerte precoz (48h) mayor del 80%28. Si excluimos estos casos, tenemos una adherencia a las Guías BTF de un 63,4%, comparable a la publicada recientemente en centros europeos (38-67%)20,22,33,56. En los sondeos iniciales realizados en Estados Unidos57,58 tras la introducción de las Guías BTF se evidenció que había una gran variabilidad institucional en el manejo de los pacientes con TCEG. Hesdorffer y Ghajar59 demostraron que, si bien se había mejorado en la adherencia a las Guías entre 1990 y 2006, seguía habiendo un 34,5% de incumplimiento entre los 413 centros participantes en el estudio.
En nuestro análisis multivariante encontramos que los pacientes con HSA, HIC y los que han sido intervenidos tienen una relación significativa con la monitorización. Además, comprobamos que se utilizó con mayor asiduidad a partir de 1995. La edad demostró una relación inversa, esto es, los pacientes de mayor edad se monitorizan raramente. La elevación de la PIC está en relación, según nuestro estudio multivariante, con la compresión cisternal y con la presencia de HSA o HIV. La edad no fue un factor pronóstico de elevación de la PIC, aunque este hallazgo podría estar sesgado por la presencia de atrofia en pacientes de edad avanzada. El limitado valor predictivo de la desviación de la línea media apreciado en la TC inicial, puede ser debido a que las lesiones-masa con desplazamiento son intervenidas antes de la monitorización de la PIC.
¿Mejora la evolución final al realizar una terapia dirigida a controlar la PIC? Es una cuestión de difícil respuesta debido a la selección de los pacientes para monitorizar. Aunque en este trabajo no hemos hablado de la evolución final, que será objeto de un estudio posterior, no hemos encontrado diferencias significativas entre los pacientes monitorizados y no monitorizados en la evolución final al año, pero en el estudio multivariante se ha encontrado una reducción muy significativa de la PIC elevada. Esta reducción podría ser debida a la implantación de las Guías de la BTF en 1996, aunque también puede ser debida a un diferente case-mix.
En los estudios estadounidenses más recientes60, en los que agrupan pacientes tratados sin monitorizar y tratados con monitorización y terapia dirigida a bajar la PIC, se ha encontrado un 12% de reducción de la mortalidad y un incremento del 6% de evoluciones favorables, lo que sugiere que la monitorización tiene un impacto positivo en la evolución final. Gerber et al.23 demostraron una marcada reducción en la mortalidad a lo largo de 9años que podría estar asociada a un aumento de la incidencia en la monitorización. Farahvaret al.61 evidenciaron una reducción del 64% de la mortalidad a las 2 semanas en aquellos pacientes que respondían a la terapia dirigida a la PIC, después de ajustar por los factores predictivos de mortalidad. El único factor demográfico relacionado con la respuesta al tratamiento fue la edad, lo que está en contradicción con nuestros hallazgos, en los que la edad no es un factor independiente de PIC elevada. Talving et al.62, en un estudio reciente en el que había un cumplimiento con las Guías BTF del 46,8%, demostraron una mejoría significativa de la supervivencia, si bien, al igual que en nuestro estudio, los pacientes de edad avanzada eran menos frecuentemente monitorizados.
LimitacionesSimilar al estudio EBIC, el nuestro es un estudio observacional, lo que conlleva determinados problemas inherentes a este tipo de estudio, tales como la falta de un comité central de evaluación y de auditoría externa, lo que puede hacer dudar de la calidad en la recolección de los casos. Tampoco existió una lectura centralizada de las TC, aunque esta fue realizada por los autores sénior con amplia experiencia en el manejo de estos casos (PAG, AL). A pesar de estos inconvenientes, la calidad de los datos ha sido satisfactoria, dado el escaso número de datos perdidos y la obtención de unos datos consistentes comprobados por un proceso de validación interna.
ConclusionesComo consecuencia de los cambios epidemiológicos que se han apreciado en los pacientes con un TCEG a lo largo de los últimos 25años, se describe un diferente patrón de lesión morfológica, reflejado en la TC, conllevando una diferente práctica clínica durante este periodo de tiempo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.