Los sarcomas granulocíticos son neoplasias sólidas compuestas de células mieloides inmaduras, de localización extramedular, asociadas a síndromes mieloproliferativos. La afectación del sistema nervioso central es muy infrecuente y puede desarrollarse tras un periodo de remisión completa, coexistir con o preceder a la enfermedad sistémica, siendo esta el elemento fundamental que orienta el diagnóstico radiológico y marca el pronóstico. En este trabajo, presentamos 2 casos de sarcoma granulocítico intracraneal, verificados desde el punto de vista patológico tras ser tratados mediante cirugía, y discutimos sus características clínicas, diagnósticas, terapéuticas y pronósticas tras realizar una revisión bibliográfica de la literatura científica destacada publicada hasta la fecha.
Granulocytic sarcomas are solid, extramedullary-located neoplasms composed of immature myeloid cells, associated with myeloproliferative syndromes. Central nervous system involvement is very rare and may develop either after complete remission, coexist with or precede the systemic disease, being the last one that guides the radiological diagnosis and marks the prognosis. In this work, we report 2 pathologically-verified cases of intracranial granulocytic sarcoma treated by surgical means. Their clinical, diagnostic, therapeutic and prognostic features are discussed in the light of the most relevant scientific literature published to date.
El sarcoma granulocítico (SG), también denominado tumor mieloide extramedular o cloroma por su típica coloración verde amarillenta, es una neoplasia sólida del sistema hematopoyético de localización extramedular y alta densidad celular, que incluye fundamentalmente granulocitos inmaduros dispuestos sobre una matriz rica en fibras de reticulina1. Se relaciona con diferentes enfermedades mielodisplásicas y mieloproliferativas, puntualmente con la leucemia mieloide aguda1. Se trata de una enfermedad de escasa prevalencia, pudiéndose diagnosticar en cualquier momento de la vida, con una incidencia reportada de 2/1.000.000 adultos, mientras que cerca del 60% de los casos son diagnosticados en menores de 15 años2. El SG puede presentarse en número y localización anatómica variable, afectando predominantemente los tejidos blandos, el sistema musculoesquelético, el peritoneo, los ganglios linfáticos y el sistema gastrointestinal3. Su desarrollo en el sistema nervioso central es excepcional, pues supone un 0,3-6% de las neoplasias hematopoyéticas3,4 y un 3-40% de los SG de cualquier localización3.
Describimos a continuación 2 casos de SG del sistema nervioso central (SG-SNC) diagnosticados en un periodo de 6 años en 2 centros neuroquirúrgicos de referencia, junto con una discusión sobre el tema elaborada tras una revisión actualizada de la literatura científica publicada hasta la fecha.
Casos clínicosCaso 1Hombre de 78 años de edad, diagnosticado en el año 2008 de una leucemia mieloide aguda (FAB M7) tratada con esquema 7/3 (citarabina-idarrubicina), seguida de consolidación con altas dosis de citarabina, al que no se realizó trasplante de médula ósea debido a la escasa reserva medular. Presentó una recaída de su enfermedad en 2016, recibiendo tratamiento de inducción con esquema 5/2 que indujo una remisión completa, presentando como complicación una hemorragia subaracnoidea espontánea asociada a trombocitopenia. Continuó tratamiento de mantenimiento con 13 ciclos de decitabina mensual.
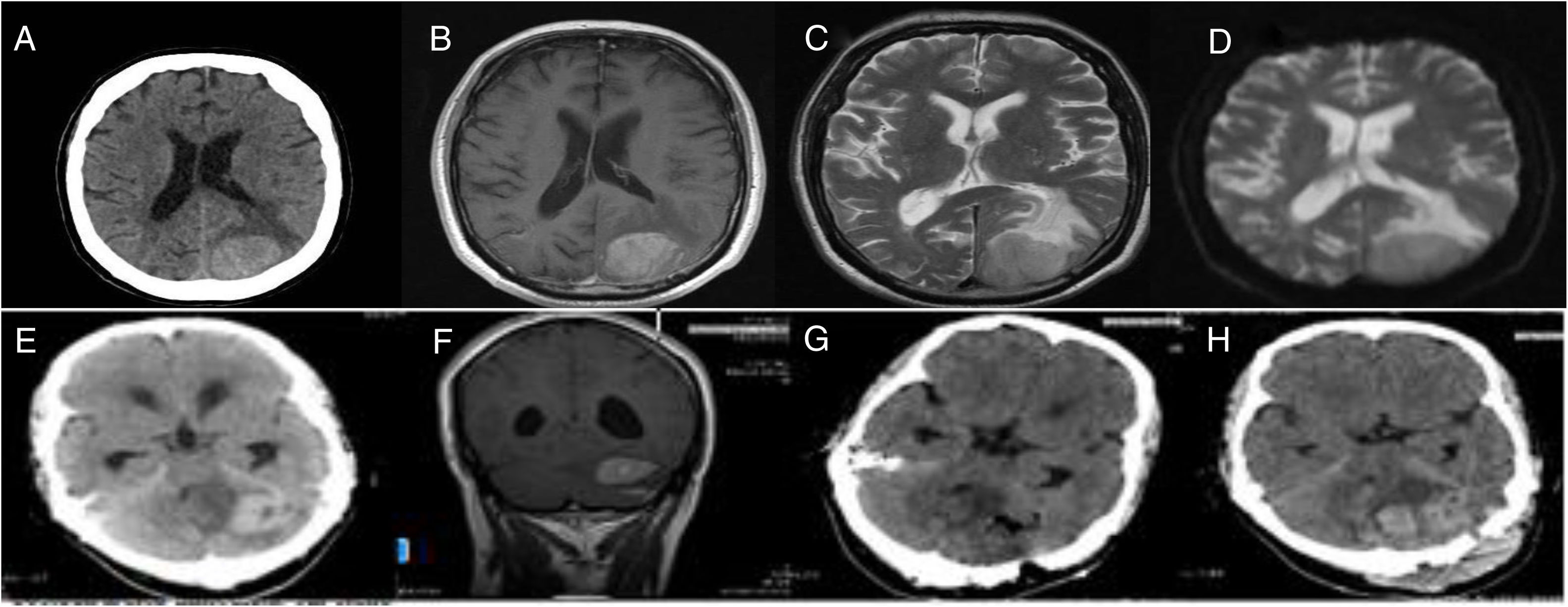
Ingresó nuevamente en el año 2018 refiriendo trastornos visuales, cefalea y somnolencia de 15 días de evolución. En el examen físico, el paciente se encontraba alerta y orientado, con hemianopsia homónima y hemiparesia (4+/5) derechas. El estudio analítico de sangre periférica no evidenció anomalías significativas, mientras que las pruebas de imagen mostraron una lesión parenquimatosa occipital izquierda, de 3,4cm de diámetro (fig. 1A-D). Se tomó la decisión de adoptar una conducta quirúrgica, mediante craneotomía occipital izquierda. Durante el procedimiento quirúrgico, a pesar de la intención inicial, solo pudo lograrse una resección subtotal, dado el carácter infiltrante de la lesión. El examen histopatológico fue diagnóstico de SG. El paciente experimentó una evolución clínica favorable y 7 días después del procedimiento quirúrgico fue dado de alta hospitalaria, tras la obtención de una TC craneal sin complicaciones agudas.
Estudios de neuroimagen de los casos 1 (A-D) y 2 (E-H). A) TC cerebral basal, que muestra un proceso expansivo sólido, hiperdenso, occipital izquierdo con amplia superficie de contacto con la duramadre y edema perilesional. En la RM, la lesión capta contraste de forma intensa y heterogénea en la secuencia T1 tras administrar gadolinio (B), es ligeramente hiperintensa en T2 (C) y muestra un valor de ADC reducido (D). E) TC que muestra un proceso expansivo hiperdenso en el hemisferio cerebeloso izquierdo, con efecto de masa sobre el cuarto ventrículo, causando hidrocefalia obstructiva. F) Corte coronal de RM en secuencia T1, tras administrar contraste paramagnético. La lesión presenta una amplia superficie de contacto con la superficie tentorial inferior, que muestra realce o «cola dural»; también se identifica un realce lineal en el margen inferior del tumor, que traduce invasión leptomeníngea/parenquimatosa. G) TC posquirúrgica inmediata, sin signos de complicaciones agudas. H) TC urgente obtenida durante el reingreso del paciente, que mostró un hematoma agudo, de desarrollo diferido en el lecho quirúrgico cerebeloso.
El paciente recibió tratamiento adyuvante con radioterapia según la técnica 3D-CRT (dosis holocraneana total 24Gy/dosis fracción 2Gy) y posterior quimioterapia con decitabina debido a la constatación de una recaída de su enfermedad en la médula ósea. Sin embargo, poco después desarrolló un cuadro clínico de somnolencia, cambios de comportamiento, disminución de la capacidad de concentración y dolor generalizado de mal control farmacológico. Se realizó una nueva TC de encéfalo que no evidenció progresión significativa de la lesión, si bien el estudio de sangre periférica mostró alteraciones hematológicas severas. Debido a la rápida progresión de su enfermedad de base, el paciente optó por la adopción de una actitud terapéutica paliativa, falleciendo poco después.
Caso 2Hombre de 43 años de edad, con el antecedente de leucemia promielocítica aguda (M3) diagnosticada y tratada con protocolo PETHEMA LPA 05 en el año 2009, logrando una remisión completa citológica y citogenética. Tras 2 ciclos quimioterápicos de consolidación y mantenimiento, desarrolló una recaída sistémica y leptomeníngea un año después, tratada con trióxido de arsénico y citarabina intratecal, consiguiendo nuevamente una remisión completa. Como complicación, presentó una meningitis por cocos grampositivos, que fue tratada con éxito mediante antimicrobianos y la retirada del reservorio de Ommaya.
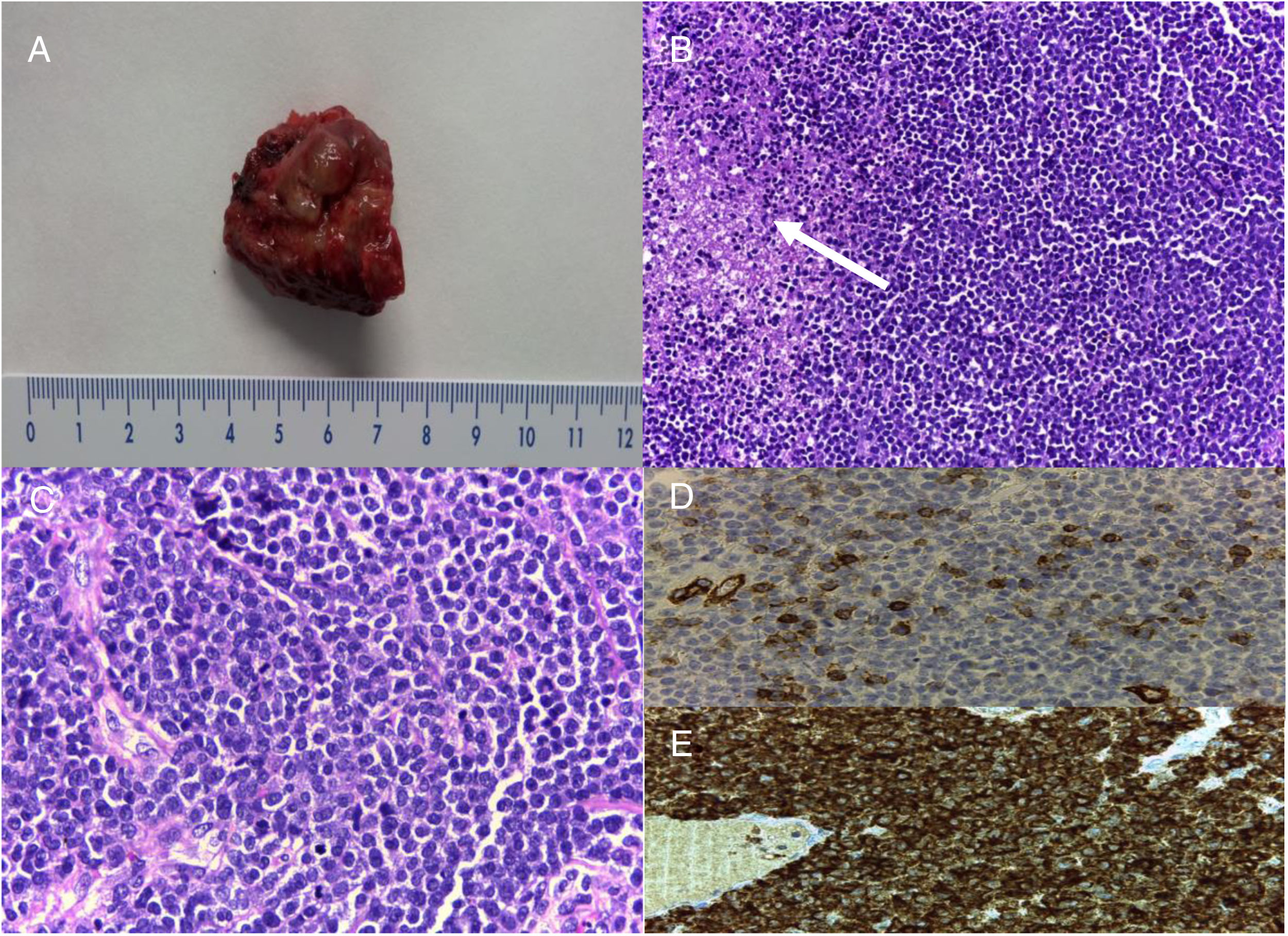
En el mes de marzo del año 2012, acudió al Servicio de Urgencias por cefalea de características orgánicas, somnolencia, vómitos e inestabilidad para la marcha de una semana de evolución. En el examen físico presentaba apertura ocular al estímulo verbal, desorientación temporal y espacial y edema bilateral de papila. No se evidenciaron otros signos de focalidad neurológica. Los estudios analíticos de sangre periférica fueron normales, mientras que las pruebas de imagen evidenciaron un proceso expansivo cerebeloso izquierdo de 4cm de diámetro máximo (fig. 1E-F). Debido al deterioro progresivo del nivel de conciencia del paciente, se procedió a la colocación de forma urgente de un drenaje ventricular externo de líquido cefalorraquídeo, registrando una presión de apertura de 30mmHg. Los estudios bioquímico, citológico e inmunológico del líquido cefalorraquídeo no revelaron datos patológicos. Seis días después, el paciente fue intervenido de forma electiva, con exéresis microquirúrgica de la lesión (fig. 2A) mediante una craneotomía suboccipital, y practicando en el mismo acto una ventriculostomía endoscópica del tercer ventrículo. El examen histopatológico del tumor mostró elementos de aspecto blástico en distintos grados madurativos, con positividad focal para CD34, CD68 y TdT, y difusa para mieloperoxidasa, lisozima, CD117, CD99 y CD68, mientras que el estudio citogenético puso de manifiesto una translocación t (15;17) (q22; q12.1) PML/RARA, aproximadamente en el 55% de los núcleos analizados, hallazgos todos compatibles con el diagnóstico de SG (fig. 2). El paciente experimentó una evolución clínica postoperatoria favorable, y las pruebas de imagen de control no evidenciaron complicaciones agudas (fig. 1G), siendo otorgada el alta hospitalaria pocos días después del procedimiento.
Estudio patológico de la pieza de resección del caso 2. A) Aspecto macroscópico de la pieza de resección. B) Neoplasia compuesta por pequeñas células redondas, con evidencia de áreas necróticas (flecha blanca) y C) frecuentes figuras mitóticas. El estudio inmunohistoquímico puso de manifiesto: D) positividad focal para CD34 y E) difusa para mieloperoxidasa.
Diez días tras el alta, el paciente acudió nuevamente al Servicio de Urgencias quejado de hemorragias en la mucosa oral de 48h de evolución, secundarias a una trombocitopenia severa según la analítica de sangre periférica obtenida en ese momento, sin otros síntomas o signos clínicos agregados. Se decidió su ingreso a cargo del Servicio de Hematología, donde fue diagnosticado de recurrencia de LPA, no pudiéndose lograr valores mayores de 30.000 plaquetas a pesar de las múltiples transfusiones administradas. Tras 48h de ingreso, el paciente experimentó un cuadro de cefalea aguda seguido de deterioro abrupto del sensorio. Se realizó una TC urgente, que mostró signos de hemorragia aguda en el trayecto de la ventriculostomía y en el lecho quirúrgico infratentorial (fig. 1H), produciéndose el fallecimiento del paciente por parada cardiorrespiratoria horas después, tras ser desestimada la realización de maniobras terapéuticas intensivas.
DiscusiónLos procesos oncológicos del sistema hematopoyético que afectan al sistema nervioso pueden presentarse en forma de meningitis o encefalitis carcinomatosas (agregados de células neoplásicas intravasculares junto con afectación parenquimatosa difusa), así como masas sólidas (SG). Estas últimas tienen una incidencia del 3-9% en pacientes con antecedentes de leucemia mieloide aguda, mientras que en aquellos que padecen un proceso mieloide crónico es 5 veces menor; además, también se reportaron en sujetos con antecedentes de síndrome mielodisplásico, síndrome hipereosinofílico y leucemia eosinofílica crónica3,5,6. Gracias al desarrollo de nuevos tratamientos para las enfermedades oncohematológicas, que pueden prolongar tanto la supervivencia como los periodos libres de enfermedad, podríamos asistir en los próximos años a un aumento de la incidencia de estos tumores.
Según la clasificación de Audouin et al., los SG pueden desarrollarse tanto en pacientes con un proceso oncohematológico conocido, típicamente durante una leucemia activa, una crisis blástica de un proceso mieloproliferativo crónico o incluso como recaída tras un periodo libre de enfermedad, como en aquellos sin evidencia de enfermedad sistémica7–9. En los primeros, se postula como mecanismo patogénico el paso de células neoplásicas desde la médula ósea a la membrana dural, los espacios de Virchow-Robin y las leptomeninges, y, finalmente, la invasión del parénquima nervioso, mientras que la aparición de masas parenquimatosas aisladas sería un fenómeno menos frecuente10,11. En el segundo supuesto, de patogenia aún desconocida, debemos resaltar que hasta un 25% de los casos desarrollará un proceso oncohematológico luego de un periodo que varía desde 15 días a 2 años3,10.
Los SG-SNC asocian una amplia variabilidad en sus formas de presentación, pudiendo afectar tanto la columna vertebral como el compartimento craneal. En la columna, suelen aparecer como masas epidurales, predominantemente en la región dorsal (73%) y la lumbar (35%), habiéndose descrito casos intramedulares puros3,6,12. Así, también los SG intracraneales pueden desarrollarse bien como masas centradas en el tejido óseo de la órbita, los senos paranasales, la base o la calota craneal, bien como un proceso expansivo extraparenquimatoso de base dural o como una lesión intraparenquimatosa, única o múltiple, sólida3. En consecuencia, los pacientes suelen desarrollar signos clínicos y neurológicos propios de un proceso expansivo, asociados o no a las manifestaciones atribuibles a un proceso oncológico del sistema hematopoyético.
Este marcado polimorfismo de los SG-SNC, junto con la ausencia de signos patognomónicos en las pruebas de imagen, hacen que con frecuencia sea el antecedente o coexistencia de un proceso sistémico oncohematológico el que oriente el diagnóstico diferencial en este sentido, como ocurrió en los casos clínicos que acabamos de presentar. En la TC, los SG-SNC suelen verse como masas iso o hiperdensas con respecto al parénquima cerebral, mientras que en la RM son heterogéneos, de señal hipo o isointensa en secuencia T1 e iso o hipointensa en las secuencias T2, con captación intensa de contraste paramagnético y edema vasogénico asociado10. El grado de afección ósea puede evaluarse a través de la ventana ósea de la tomografía y la secuencia T1 con supresión grasa tras la administración de contraste, mientras que la secuencia FLAIR permite identificar signos de infiltración pial, leptomeníngea, perivascular o ependimaria. La secuencia T2-GRE permite la diferenciación con hematomas, debido a que pueden ser confundidos en la tomografía por su alta densidad, aunque los SG-SNC también pueden asociar epifenómenos de sangrado10. Dependiendo del patrón radiológico específico, estos tumores pueden plantear un arduo diagnóstico diferencial con otros procesos expansivos extraaxiales más frecuentes, las metástasis o los linfomas10.
El establecimiento de un diagnóstico definitivo de SG-SNC requiere habitualmente el estudio de muestras de biopsia. Debe realizarse un diagnóstico diferencial patológico con otros de tumores de células pequeñas como el linfoma de Burkitt, el sarcoma de Ewing y el rabdomiosarcoma embrionario; a este respecto, el estudio inmunohistoquímico mediante mieloperoxidasa, CD68/KP-1, CD34, CD43, CD117, CD68/PGM-1, lisozima, CD3, CD163 y CD20 permite identificar la mayoría de SG, mientras que la expresión de CD45 es variable3,13.
El tratamiento de elección de los SG-SNC es el de su enfermedad hematológica de base, por lo que la indicación quirúrgica es controvertida, pero indudable en aquellos pacientes que presentan un déficit neurológico progresivo que no responde al tratamiento médico, así como en aquellos pacientes con afectación aislada del SNC, sin evidencia ni antecedente de enfermedad sistémica. Esta conducta terapéutica parece favorecer un aumento del tiempo libre de síntomas, como así también la respuesta a la radioterapia, logrando un mayor control local de la enfermedad aunque no modifica la supervivencia global6. Sin embargo, pueden darse serias limitaciones para el acto quirúrgico, habiéndose descrito el carácter infiltrativo de algunos SG-SNC que impide una resección agresiva, como en nuestro caso 1, y la presencia de enfermedad sistémica severa no controlada, especialmente si cursa con trombocitopenia profunda y refractaria a tratamiento, como ocurrió tras la cirugía en el caso 2. Tras el procedimiento quirúrgico, se utiliza tratamiento adyuvante con radioterapia, quimioterapia o ambas modalidades. En el caso de ausencia de enfermedad sistémica concurrente o previa (recurrencia focal tras remisión completa), la aplicación de tratamiento oncológico es más controvertida, pero razonable desde nuestro punto de vista, dado el carácter prodrómico, impredecible, de la afectación del sistema nervioso10.
ConclusiónLos SG-SNC son extremadamente raros y suelen coexistir con o preceder a un proceso oncohematológico sistémico, o desarrollarse tras un periodo de remisión. Se trata de lesiones muy polimorfas, que pueden confundirse desde el punto de vista radiológico con otras entidades más frecuentes. Existe controversia respecto a la indicación de tratamiento quirúrgico, aunque estaría recomendado en pacientes con sintomatología neurológica severa progresiva, siempre que la situación sistémica se halle controlada.